三穴五针对哮喘大鼠肺组织中Eotaxin、RANTES表达的影响
魏 旭1,韩君萍1,虞跃跃1,李 双1,赵 叶1,杨金华1,崔建美1
(1 华北理工大学,河北唐山 063000)
摘要:研究目的:探讨三穴五针对哮喘大鼠肺组织中Eotaxin、RANTES表达的影响。研究方法:将30只SPF级雄性SD大鼠随机分为空白对照组、哮喘模型组和针刺干预组,每组10只。各组分别给予相应干预后,采用生理记录仪连续记录气道阻力和肺顺应性,HE染色法观察大鼠肺组织的病理变化,免疫组化检测肺组织中Eotaxin、RANTES的表达。研究结果:哮喘模型组气道阻力较空白对照组明显升高(P<0.05),针刺干预组气道阻力较哮喘模型组明显降低(P<0.05);哮喘模型组肺顺应性较空白对照组明显降低(P<0.05),针刺干预组肺顺应性较哮喘模型组明显升高(P<0.05);HE染色镜下观察哮喘模型组大鼠肺组织病理改变及炎症程度明显,经“三穴五针法”针刺干预后,病理改变及炎症反应均明显减轻;哮喘模型组Eotaxin、RANTES表达水平显著高于空白对照组(P均<0.05),针刺干预组Eotaxin、RANTES表达水平较哮喘模型组明显降低(P均<0.05)。结论:三穴五针可以有效降低哮喘大鼠肺组织中Eotaxin、RANTES的含量,减轻气道炎症反应。
关键词:针刺;哮喘;嗜酸性粒细胞特异性趋化因子;调节激活正常T细胞表达;分泌细胞因子
Regulation of Three-acupoint and Five-needling Method on Eotaxin and RANTES Expressions in Lung Tissues of Asthmatic Rats
WEI Xu1, HAN Jun-ping1, YU Yue-yue1, LI Shuang1, ZHAO Ye1, YANG Jin-hua1, CUI Jian-mei1
(1 North China University of Science and Technology, HebeiTangshan 063000)
Abstract: Objective: To explore the effects of three-acupoint and five-needling method on Eotaxin and RANTES expressions in lung tissues of asthmatic rats. Methods: Thirty SPF male SD rats were randomly divided into blank group, model group and acupuncture group with 10 rats in each group with corresponding interventions. Physiological recorder was used to record airway resistance and pulmonary compliance, HE staining was applied to observe the morphologic changes of lung tissues, the immunohistochemical method was applied to test the expression of Eotaxin and RANTES in lung tissues. Results: Compared with the blank group, the airway resistance was higher in the model group(P<0.05),compared with the model group, the acupuncture group reduced (P<0.05). Compared with the blank group, the pulmonary compliance reduced in the model group(P<0.05), compared with the model group, the acupuncture group improved(P<0.05). HE staining of rat lung indicated that the pathological changes of acupuncture group was obvious, inflammatory reaction was reduced after acupuncture. Compared with the blank group, the expression of Eotaxin and RANTES in lung tissues of model group was higher(P<0.05), the acupuncture group was reduced(P<0.05). Conclusion: Three-acupoint and five-needling method could reduce Eotaxin and RANTES expressions in lung tissues of asthmatic rats, thus reducing airway inflammatory reaction.
Key words: acupuncture; bronchial asthma; Eotaxin; RANTES
支气管哮喘是当今社会最常见的慢性疾病之一,是一种以多种炎症细胞和一系列细胞因子参与为特征的气道慢性炎症性疾病[1]。临床表现为呼气性呼吸困难、反复发作性喘息、咳嗽或胸闷等症状,每于夜间和(或)清晨发作。据世界各国流行病学调查结果显示,目前全球约有3亿哮喘患者[2],其中儿童患病率在3.3%-29%[3],成人患病率在1.2%-25.5%[3],被世界卫生组织列为四大顽症之一。针刺防治哮喘疗效确切,副作用小,价格相对较低,逐渐成为我国防治哮喘的特色之一。然而针刺治疗哮喘的作用机制尚未完全明确[4],本实验采用HE染色法、免疫组化法等观察针刺对支气管哮喘大鼠肺组织病理改变及Eotaxin、RANTES的表达,以探讨针刺改善哮喘大鼠气道炎症的作用机制。
1 材料与方法
1.1 实验动物
SPF级SD大鼠30只(购自天津市山川红实验动物科技有限公司,许可证号:SYXK2015-0038),雄性,120±10g,。大鼠饲养于华北理工大学实验动物中心屏障环境,动物实验设施[使用证明:MY10DXK07],温度设定20-25℃,湿度设定60%-70%。实验过程中对动物的处置符合《关于善待实验动物的指导性意见》(2006)的相关规定。
1.2 主要试剂和仪器
卵蛋白(A5503-10G,美国Sigma公司);雾化吸入器(085G3005,德国PARI);一次性无菌针灸针(华佗牌);生理记录仪;切片机(RM223型,德国莱卡);兔抗大鼠Eotaxin抗体(A7569,abclonal);兔抗大鼠RANTES抗体(A5630,abclonal);山羊血清(792740,Blological Industries);兔抗大鼠荧光二抗(100944,KPL);DAPI(035M4029V,SIGMA);荧光防淬灭封片剂(150529,KPL);酶标仪(M200PRO,TECAN)。
1.3 方法
1.3.1 实验分组
30只SPF级SD大鼠根据随机数字表随机分为3组,每组10只,为保证组间只有一个不同处理因素,具体分组如下:(1)空白对照组:用生理盐水代替卵蛋白(OVA);(2)哮喘模型组:按大鼠哮喘模型制备方法进行造模,但不给予针刺处理;(3)针刺干预组:自造模之起采用“三穴五针法”给予针刺处理。
1.3.2 大鼠哮喘模型制备
哮喘模型组及针刺干预组SD大鼠腹腔注射生理盐水配制的卵蛋白(OVA)悬液1ml(含1mg卵蛋白(OVA)和10mg Al(OH)3凝胶),并于第8天重复注射1次,第9天开始用1%OVA混悬液雾化吸入激发,每次30min,每日1次,激发4周。空白对照组大鼠腹腔注射及雾化吸入相同剂量的生理盐水,且时间地点与模型组应保持一致。
1.3.3 “三穴五针法”针刺干预
自造模之日起开始针刺,穴位选取大椎、双侧风门、双侧肺俞。针刺方法与疗程:平补平泻,留针20min,5min行针1次(捻转速度200次/min,捻针20次为行针1次),隔日1次,共针4周。
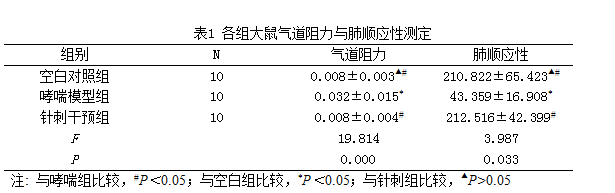
1.3.4 气道阻力与肺顺应性测定
用10%的水合氯醛按3.5mL/kg腹腔注射麻醉,将气管和食管切开后插管,然后用生理记录仪连续记录气道阻力(R)和肺顺应性(C),共记录30min。
1.3.5 肺组织病理学观察
三组大鼠分别检测气道阻力后,迅速结扎大鼠右肺中叶,右心室头皮针插管并在左心耳剪开一切口,用无菌生理盐水快速行肺循环灌注至双肺苍白色。将心肺和气管完整取出,剥离肺,生理盐水漂洗干净,吸水纸拭干。剪出结扎的右肺中叶,进行HE染色:4%多聚甲醛固定肺组织标本,24h后清水冲洗过夜,梯度乙醇脱水、透明,浸蜡组织,石蜡包埋,连续切片(4μm厚度)。HE染色后显微镜下观察炎性细胞的浸润及肺组织结构的病理改变。
1.3.6 免疫组化检测肺组织中Eotaxin、RANTES蛋白的表达
各组大鼠石蜡切片后,免疫组化步骤如下:(1)将石蜡切片在65℃烤片机上烤片40min后,室温放置5min;(2)常规石蜡切片脱蜡后,放入纯水中2min;(3)放入微波炉中高火煮沸后,将玻片放入插槽中,改中火7min进行高温修复;取出后室温30min冷却后,PBS洗涤5min×3次;(4)H2O2(消除内源性过氧化物酶)放在湿盒中15min过PBS 3min×3;擦片后加入一抗4度冰箱过夜;(5)拿出湿盒室温孵育1h后,PBS冲洗2min×3次;(6)加二抗孵育15min后,PBS冲洗3min×3次;(7)DAB(纯水:试剂A:试剂B:试剂C为20:1:1:1)显色7min;(8)用显微镜观察,备一盆水用于终止染色;终止染色后,苏木素染色3min后,清水洗2次,镜下观察染色情况来定分化时间;盐酸分化10s后,流水返蓝30min;(9)梯度酒精脱水,中性树固封。用Image pro plus6.0软件测量IOD值。
1.3.7 统计学处理
实验数据以均数±标准差进行描述,多样本均数比较用单因素方差分析(one-way ANOVA),满足正态性和方差齐性时,两两比较采用LSD法检验;方差不齐时,选用Dunnett’S T3法检验,检验水准α=0.05。各组数据均用SPSS 17.0统计软件进行分析。
2 结果
2.1 肺顺应性和气道阻力肺顺应性
哮喘模型组气道阻力较空白对照组明显升高(P=0.015,<0.05),针刺干预组气道阻力较哮喘模型组明显降低(P=0.000,<0.05)。哮喘模型组肺顺应性较空白对照组明显降低(P =0.012,<0.05),针刺干预组肺顺应性较哮喘模型组明显升高(P=0.047,<0.05)(表1)。
2.2各组大鼠肺组织病理变化
经HE染色观察显示,空白组大鼠肺组织形态学正常。哮喘模型组大鼠肺组织可见肺泡内结构损坏,支气管黏液水肿,粘液栓形成,管腔变窄,气道平滑肌肥大增厚,支气管上皮结构不规则、细胞脱落;气道壁及肺间质中大量炎细胞浸润。针刺干预组较哮喘模型组有明显好转,肺组织炎症减轻,气管及肺泡形态结构较完整,管腔内偶见分泌物滞留,炎性细胞少量分布,气道平滑肌增厚及狭窄显著好转,与空白组较接近。见图1。
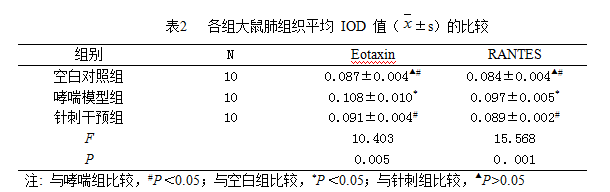
图1 各组大鼠肺组织病理变化(HE×200)箭头所指为气管
2.3各组大鼠肺组织Eotaxin、RANTES蛋白阳性表达的值
哮喘模型组大鼠肺组织Eotaxin、RANTES的表达水平显著高于空白对照组P= 0.002、P= 0.000,均<0.05),针刺干预组大鼠肺组织Eotaxin、RANTES的表达水平较哮喘模型组明显降低(P=0.007、P= 0.005,均<0.05)(表2)。

3讨论
现代医学对哮喘发病机制的分析,大多集中在气道高反应、气道炎症及气道重塑等方面[5]。而对哮喘大鼠气道高反应性的评估主要通过观察大鼠肺组织气道阻力及肺顺应性的变化。气道阻力主要指气体通过呼吸道遇到的摩擦阻力,其变化与管腔的半径4次方成反比,所以在哮喘发作支气管收缩时,管腔半径的小变化,就会导致气道阻力发生巨大改变。肺顺应性是测定肺的弹力是否正常的一种方法,能够反映肺的弹性,当气道任一部位发生狭窄或阻塞即可使肺顺应性降低[6]。本实验结果显示,哮喘模型组气道阻力较空白对照组明显升高(P<0.05),针刺干预组气道阻力较哮喘模型组明显降低(P<0.05)。哮喘模型组肺顺应性较空白对照组明显降低(P<0.05) ,针刺干预组肺顺应性较哮喘模型组明显升高(P<0.05)。说明哮喘发作可致气道阻力增加肺顺应性降低,经针刺后可有效改善气道阻力,增强肺顺应性从而抑制哮喘支气管痉挛收缩降低兴奋传导。
气道炎症作为哮喘重要的发病机制,与气道高反应性关系密切,嗜酸性粒细胞(EOS)是支气管哮喘气道炎症的关键效应细胞,大多数炎性细胞最终通过EOS产生效应,它在哮喘气道的聚集是哮喘发作的一个中心环节[7],同时其在气道的浸润与活化也决定了哮喘的严重程度[8]。Eotaxin 是近年来发现的嗜酸粒细胞趋化因子,由嗜酸性粒细胞、上皮细胞、平滑肌细胞等多种细胞产生,在肺脏内主要为支气管和肺泡上皮产生,其主要化学作用是吸引EOS在肺内的募集,是一种EOS化学激动剂[9]。且Eotaxin 是唯一一个仅与单一受体CCR-3发生作用而介导EOS从血管迁移至炎症肺组织中的趋化因子,趋化嗜酸性粒细胞向炎症部位聚拢,从而引起局部嗜酸性粒细胞炎症发生[10-12]。调节激活正常T细胞表达和分泌细胞因子(RANTES)是第一个被证实的具有趋化Eos功能的CC趋化因子,在哮喘的早期和后期对嗜酸性粒细胞的趋化作用起到了重要作用。RANTES主要来源于淋巴细胞、上皮细胞和嗜酸性粒细胞。在哮喘的变态反应性炎症过程中,RANTES一方面可促进嗜酸性粒细胞从骨髓中释放;另一方面,局部释放的RANTES还可招引嗜酸性粒细胞聚集于支气管气道组织中,激活炎症细胞,使炎症介质释放增加,形成嗜酸性粒细胞为主的效应细胞形成的气道炎性病变。有研究证实RANTES的表达升高与气道炎症的严重程度关系密切[14]。本实验结果显示,HE染色镜下哮喘模型组大鼠肺组织病理改变及炎症程度明显,经“三穴五针法”针刺干预后,上述改变明显减轻。哮喘模型组大鼠肺组织Eotaxin、RANTES的表达水平显著高于空白对照组(P均<0.05),针刺干预组大鼠肺组织Eotaxin、RANTES的表达水平较哮喘模型组明显降低(P均<0.05)。以上说明,针刺治疗可能有效地降低哮喘模型大鼠肺组织中Eotaxin、RANTES的含量,减轻气道炎症反应,从而控制哮喘的发作。
参考文献
[1]王俊壹,张卫华,刘舟.近三年中药治疗哮喘的实验研究进展[J].光明中医, 2015, 30(12): 2536-2538.
[2]Masoli M, Fabian D, Holt S, et al. The global burden of asthma: executive summary of the GINA Dissemination Committee report [J]. Allergy, 2004, 59(5): 468- 478.
[3]柏娟,赵京,申昆玲,等.北京、重庆、广州三城市儿童哮喘患病情况调查[J].中华临床免疫和变态反应杂志, 2010, 4:280-284.
[4]Kimura H, Ryo A. Pathophysiology and epidemiology of virusinduced asthma[J]. Front Microbiol,2014,5:562.
[5]赵彩霞.支气管哮喘发病机制的研究进展[J].医学理论与实践, 2016, 29(7): 870- 872.
[6]徐叔云,卞如濂,陈修.药理实验方法学.第1版.北京:人民卫生出版社, 1982, 913- 922.
[7]Lampinen M, Hakansson L, Venge P. Interleuk in-2 inhibits eosinophilmigration but is counteracted by IL-5 prining [J]. Clin Exp Allergy, 2001,31(2):249.
[8]Kitayama J, Mackay C R, Ponath P D, et al. The C-C chemokine receptorCCR3 participates in stimulation of eosinophil arrest on inflammatory endothelium in shear flow [J]. J Clin Invest, 1998,101(9): 2017.
[9]田维敏,尚云晓,蔡栩栩,等.1,25-二羟维生素D_3对哮喘大鼠BALF中Eotaxin及IL-8表达的影响[J].实用药物与临床, 2011, 14(6): 451-454.
[10] 曾泽戒.嗜酸粒细胞特异性趋化因子eotaxin.国外医学:呼吸系统分册,2003,23(2):66-69
ZENG Ze-jie.Eosinophilic chemotactic factor,eotaxin.Foreign Medical Sciences Section of Respiratory System,2003,23(2):66-69
[11] Pease J E,Williams T J.Eotaxin and asthma.Curr Opin Pharmacol2001,1:248-253
[12]Humbles AA, Conroy DM, Madeau S. Kinetics of eotaxin generation and its relationship to eosinophil accumulation in allergic airways disease: analysis in a guinea pig model in vivo [J]. J Exp Med,1997,18:601-612.
[13]Pan ZZ, Parkyn L, Ray A, et al. Inducible lung-specific expression of rantes: preferential recruitment of neutrophils [J]. Am J Physiol Lung Cell Mol Physiol, 2000, 279(4): L658- L666.

 世界针灸学会联合会
世界针灸学会联合会