电针对脑缺血再灌注大鼠内质网应激关键因子 GRP-78、caspese-12 表达的影响 1
余琴华 于涛 徐建永 谢天炽
(1. 广州医科大学卫生职业技术学院针灸推拿教研室,广东 广州 510925;2.广东省中医院针灸科,广东 广州510120;3.广州医科大学卫生职业技术学院生物化学教研室,广东 广州 510925;4.广州医科大学遗传与细胞生物学教研室,广东广州 511436;)
【摘要】目的:观察电针对脑缺血再灌注不同时点模型大鼠 GRP78、caspase-12 水平的影响,探讨电针对神经元细胞凋亡通路分子机制的可能影响。方法: 126 只 SD 大鼠随机分为假手术组(sham 组)、模型对照组(I/R 组)、电针治疗组(EA 组),sham 组 6 只,I/R 组和 EA 组各 60 只。采用改良线栓法制备局灶性脑缺血再灌注模型,对再灌注 6、12、 24、 48、72h 等不同时间点进行神经学分级评定,观察再灌注 24h 脑片皮质和海马 CA1 区的形态学改变,TUNEL 法检测各组神经细胞凋亡指数。采用免疫组化和 Western blotting 观察不同组别不同时间点损伤区皮质、海马内 GRP78、caspase-12蛋白表达的变化。结果:与 I/R 组比较,除再灌注 6h 时间点外,其余各个时间段, EA 组神经学评分降低(P< 0.01);各再灌注时点 EA 组的凋亡指数降低(P< 0.01)。各组比较, EA 组的 GRP78 和 caspase-12 蛋白表达量均比 I/R 组降低(P<0.05)。结论:电针对脑缺血再灌注后不同时间所致缺血脑神经细胞凋亡有减轻作用可能通过抑制 GRP78、caspase-12 的释放和激活,降低凋亡率,发挥神经保护作用。
【关键词】 电针;脑缺血再灌注损伤;细胞凋亡;内质网; GRP78;caspase-12
Effects of electroacupuncture(EA) on the expression of the ERS key factor—key genes GRP78 and Caspase-12 after Focal Cerebral Ischemia-Reperfusion Injury in rats.YU Qin-hua,YU Tao,XU Jian-yong, XIE Tianchi,(1.Teaching and research section of acupuncture and tuina, College of Health Sciences, Guangzhou Medical University,Guangzhou 510925, China. 2.Department of acupuncture and moxibustion,Traditional Chinese Medicine Hospital of Guangdong Province,Guangzhou 510120, China 3.Teaching and research section ofbiochemistry, College of Health Sciences, Guangzhou Medical University, Guangzhou 510925,China.4. Teaching and research section of genetic and cell biology, Guangzhou Medical University,Guangzhou511436,China.)
【Abstract 】 Objective In this study, from the perspective of apoptotic signaling pathways after cerebral ischemia and reperfusion in rat model of electricity Intervention different time periods, to observe the critical factor in rat endoplasmic reticulum stress in the system -GRP78, caspase-12 the impact of further argued EA affect some molecular mechanisms of neuronal apoptosis pathway. Method The126 rats were randomly divided into three groups includingsham-operation group(6), I/R group(60), and EAgroup(60).The model of focal cerebral ischemia reperfusion injury were induced by using modified thread embolizing in rats. Neurography grade were evaluated at 6h,12h,24hand 48h,72h after cerebral ischemia/reperfusion, and the pathology changes was observed at 24h reperfusion time. Immunohistochemicalmethod and

Western blotting were performed toexaminetheexpressionof GRP78 andcaspase-12 method at different time point after reperfusion. Apoptosis was also characterized by TUNEL staining. ResultsCompared with the I/R group, the neurologic scores of EA group decreased (P < 0.01) during the remaining time periods except for the 6h time point. Apoptosis index of the EA group was decreased in each reperfusion period (P < 0.01)The expression of GRP78 and caspase-12 protein in EA group were lower than that of I/R group (P < 0.05).Conclusion Through dynamic observing cell damage, apoptosis and apoptosis signal key molecular contrast research of EA on cerebral ischemia reperfusion at different time periods, we found that at different time after cerebral ischemia reperfusion reducing effect, EAintervens in ESR dependent apoptopic pathway,EA lower AI and play the nerve protective effects by inhibiting the release of GRP78 and activation of caspase-12 .
【Key words】 electroacupuncture;cerebral ischemia /reperfusion injury; apoptosis; ERS ; GRP78;Caspase-12
脑缺血后再灌注一方面会改善脑组织缺血缺氧程度,另一方面也会触发一系列复杂的级联反应,包括氧自由基产生、钙超载、线粒体损害等,从而导致多种形式的神经细胞凋亡。内质网应激(endoplasmic reticulum stress, ERS) 反应性凋亡途径是一条有别于死亡受体介导和线粒体介导的新的信号通路[1],它在多种疾病发生发展中都扮演重要角色[2-3]。研究发现脑缺血再灌注后存在钙稳态失衡和过氧化损伤,由此可引起内质网应激反应,诱发细胞凋亡,内质网应激在脑缺血再灌注损伤的过程中,处于中心地位[4]。针灸等中医特色疗法在早期介入缺血性脑卒中有较好疗效,可能是因为针灸等传统治疗手段有其多靶点、多途径的作用特点,对机体产生整体作用而不在于局部“阻断”[5]。本研究重点观察了电针对大鼠脑缺血再灌注后 ERS 介导凋亡关键的信号分子—GRP78、caspase-12 表达的影响,分析针刺对脑缺血再灌注后神经元凋亡信号通路干预的可能机制,为针刺疗效提供进一步的分子生物学作用机理。
材料与方法
1 动物健康雄性 SPF 级 SD 大鼠 126 只,体重 (200±50)g。由广东省医学实验动物中心提供。动物合格证号:2013A008。许可证号:SCXK (粤)2013-0002。广州医科大学动物实验中心清洁级动物房饲养,室温设置:21~27℃,湿度 50%~70%,自由饮水、进食,适应性饲养 1 周。通过广州医科大学实验动物伦理审核。
2 试剂与仪器 手术显微镜及器械(苏州医疗器械总厂),BL2410 生物机能实验系统(成都泰盟科技有限公司) ;华佗牌无菌针灸针(0.25mm×40mm,苏州医疗用品有限公司,150601),G6805 型电针仪(上海医疗仪器厂,YZB/沪 0735-26-2012);TUNEL 试剂盒(武汉博士徳生物, MK1020);蛋白酶 K (同上, AR0056); BCIP/NBT 显色液 (同上,AR0043);核快红复染液(福州迈新生物科技,CTS-3099);鼠 SP kit 试剂盒(福州迈新生物科技, KIT -9701);组织蛋白提取液(碧云天生物, P0013G);广谱蛋白 marker(碧云天生物,P0010);羊抗兔 IgG-HRP(北京博奥森生物,bs-0295G);GRP78 单克隆抗体(美国 abcam, ab104369); 兔抗 Caspase-12 多克隆抗体(美国 abcam, ab104224);ECL 高灵敏度化学发光检测试剂盒(赛哲生物,G3308);其余试剂均为市售国产分析纯级。
3 实验方法将 126 只 SD 大鼠随机分为假手术组(sham 组)、模型组(I/R 组)、电针治疗组(EA 组)。假手术组只作 24h 时间点,余两组再随机分为再灌注 6h 组、 12h 组、24h 组、48h 组、72h 组,每组 12 只。采用改良的线栓法[6]制备大鼠局灶性大脑中动脉阻断缺血再灌注模型,缺血 2h 后将栓线退出直至头端达到颈总动脉分叉处(有阻力感),进行 5 个时段的再灌注。 sham 组只分离神经和血管,不插入线栓。 EA 组取穴标准及针刺深度参照中国针灸学会实验针灸研究会华兴邦等制定的《常用动物腧穴图谱》标准[7]而定针刺穴位。电针时选取督脉经穴百会、大椎 2 穴,“百会”穴平刺,“大椎”穴斜
刺(约 30 度角),深度均为 5mm。捻转刺激 30s 后,接 G6805 型电针仪,采用疏密波,5-10Hz,以穴周组织轻微抖动为度,约 3-5V,每次时间 30min,缺血再灌注后 2h 电针治疗一次,以后每 12h 治疗一次。 sham 组和 I/R 组大鼠每次均被抓取并且捆绑固定于针灸治疗台上 30min,但不做任何治疗。
4 神经学评分 术后缺血 2h 再灌注 6h,12h,24h,48h,72h 时,参照行为检查评分标准[8]由 2 人分别以单盲法对大鼠进行打分,再将记分结果进行平均后的得分纳入统计计算。
5 检测指标及方法
5.1 组织取材 对各组大鼠进行神经学评分后,以 1ml10%水合氯醛注射麻醉至其深度昏迷。Western Blotting(WB)检测大鼠脑组织取材方法:将麻醉大鼠迅速断头取出完整脑组织置于冰板上,从视交叉后 1 和 4mm 处各切一刀,取中段迅速放入 EP 管中,投入液氮速冻,随后保存于-80℃冰箱中,用于蛋白的提取。石蜡标本制作的大鼠脑组织取材方法:将深度麻醉大鼠用 100m1 肝素生理盐水快速灌注冲洗,随后以 4%多聚甲醛 PBS 缓冲液(40℃ pH7.4)经主动脉弓灌注约 30 分钟。立即取脑,所取部位与用来做 WB 检测部位同, 置于 10%福尔马林溶液中 4℃固定 7d, 常规冲洗、脱水、透明、包埋,做成石蜡块,连续冠状切片,片厚 5μm 取上述各组石蜡切片,常规 HE 染色,在光镜下观察。
5.2 凋亡细胞 将上述制备的石蜡切片脱蜡,严格按 TUNEL 试剂盒的说明进行染色,二氨基联苯胺
(DAB)显色,设立阳性对照(加 DNaseI 1ug/ml)、阴性对照(不加 TdT)切片。于光镜下观察,TUNEL阳性细胞胞核中呈现蓝黑色颗粒。每组每只动物随机取 3 张切片,在 400 倍光镜下,随机选取缺血半暗带区相应部位 30 个视野,计数阳性细胞数及细胞总数,计算凋亡指数 AI =TUNEL 阳性细胞数/细胞总数×100%。
5.3 GRP78 和 caspase-12 将石蜡切片常规脱蜡至水。枸橼酸盐微波修复,室温放置冷却; 0.2MPBS 冲洗 3 次后滴加 GRP78 浓缩液 1: 200 稀释液,或 caspase-12 浓缩液 1: 100 稀释液 50μl 于玻片上,放于湿盒 4℃过夜;0.2MPBS 冲洗 3min×3 次后滴加二抗,室温静置 10min; 0.2MPBS 冲洗 3min×3次后加第三抗体 (S-A/HRP) 1:100, 37℃放置 10min;0.2MPBS 冲洗 2min×3 后滴加新鲜配制的 DAB显色液,显微镜下观察,出现较强的棕黄色后终止染色,然后充分冲洗;苏木素淡染细胞核 3 min,水洗,酒精梯度脱水,二甲苯透明封片,显微镜下观察。每次实验均设立替代对照组(以兔血清替代
一抗)及空白对照组(以 PBS 替代一抗)。胞浆中出现棕黄色颗粒、胞核不着色者为免疫阳性细胞。每组每只动物随机取 3 张切片,随机选取缺血半暗带区相应部位 10 个不重复视野,计数阳性细胞数。
5.4 蛋白定量 取冷冻组织 50mg,放入 1.5ml 离心管。加入 500µl 细胞裂解液,超声波破碎仪破碎后,补加 200 裂解液至 700µl,混匀后充分裂解 30min。40℃, 12000rpm,15min 离心。转移上清至新的离心管内,-70℃保存。按照 BCA 蛋白定量试剂盒使用说明测定蛋白浓度。取 40 µg 蛋白样品上样,用 12% SDS-PAGE 胶进行电泳分离,利用电转系统转至 PVDF 膜印迹。用 TBST 配制的 5%的脱脂奶粉作为封闭液封闭 1h。将配制好的一抗:兔抗鼠 GRP78 单克隆抗体(1:1000),兔抗鼠 caspase-12多克隆抗体 (1:800)分别倒入塑料槽内,室温放置 30min 后,4℃过夜。次日,分别加入羊抗兔 IgGHRP,室温孵育 1 h,TBST 漂洗 3 次后,暗室内 ECL 化学发光显影、定影。将定影后的胶片照相,并用 Quantity one 软件对结果进行灰度值分析。6 统计学处理 用 SPSS19.0 软件包进行数据分析。采用多样本比较的均数间两两比较,当各处理组实验结果方差齐性好,应用 Tukey 法;各处理组实验结果方差不齐,应用多样本比较的秩和检验。实验数据用均数±标准差(x±s)表示,P<0.05 或0.01 为差异有统计学意义。
结 果
1 各组神经功能评分的比较(表1)假手术组神经学评分为0,与I/R组相比,EA组随着再灌注时间延长,神经功能评分逐渐减少,提示神经功能缺损程度逐渐改善(同一组别再灌注不同时间点比较P< 0.05,P<0.01)。与I/R组比较,EA组再灌注6小时各组神经学评分差异无统计学意义,其余各个时间段神经学评分均小于I/R组(P< 0.01)。


注:与 I/R 组比较::* P< 0.05。 同一组别不同时点比较:P△< 0.05,P&< 0.01。
2 病理形态学观察: 光镜下观察 HE 染色,主要观察缺血 2h 再灌注 24h 各组海马 CA1 区的形态学改变(图 1)。I/R 组海马 CA1 区细胞层次紊乱,神经元嗜酸性变,出现大量杆状或三角形外观神经元;EA 组海马 CA1 区细胞排列尚规整,可见较多核膜完整、核仁清晰的神经元。提示 EA 组神经细胞损伤在形态学上有明显改善。
3 凋亡细胞(表 2):凋亡指数在再灌注 24h 点到达高峰后开始减少(同一组别再灌注不同时间点比较 P<0.01)与 I/R 组比较,EA 组的凋亡指数变化规律与其基本一致,但每各再灌注时间点 EA 组的凋亡指数总比 I/R 组降低(P< 0.01)。

注: 经统计学处理,与模型(I/R)对照组比较::P△< 0.05,P*< 0.01。 同一组别再灌注不同时间点比较:P
&< 0.05,P#< 0.01。
4 GRP78 和 caspase-12 免疫组化(表 3、4,图 2、3) :假手术组有少量 GRP78 免疫阳性细胞(2.12±0.68)出现,极少数 caspase-12 免疫阳性细胞(1.46±0.48)出现。各组脑缺血 2h 再灌注 6h 缺血半暗带区(IP 区)即有 GRP78 免疫阳性细胞出现,随再灌注时间的延长阳性细胞数不断增长,再灌注 12h 到达表达高峰,24h 后表达开始减少;而各组脑缺血 2h 再灌注 6h IP 区有少量 caspase-12 免疫阳性细胞出现,随再灌注时间的延长阳性细胞数不断增长,再灌注 24h 到达表达高峰,48h 后表
达开始减少(同一组别再灌注不同时间点比较 P< 0.05)。与 I/R 组比较,EA 组各时间点的 GRP78、caspase-12 免疫阳性细胞计数下降(P< 0.05,P<0.01)。
表 3 缺血 2h 再灌注各时间点 GRP78 阳性细胞计数比较 (个/高倍镜视野) (x±s,n=6)
Table 3 Comparison oftheexpressionof GRP78 method at different time point after reperfusion (x±s,n=6)

注: 经统计学处理,与模型(I/R)对照组比较::P△< 0.05,P*< 0.01。 同一组别再灌注不同时间点比较:P
&< 0.05,P#< 0.01。
表 4 缺血 2h 再灌注各时间点 caspase-12 阳性细胞计数比较 (个/高倍镜视野) (x±s,n=6)
Table 4 Comparison oftheexpressionof caspase-12 method at different time point after reperfusion(x±s,n=6)

5 GRP78 和 caspase-12 蛋白定量(表 5、 6,图 4、 5):免疫印迹结果与免疫组化结果相吻合,各组脑缺血 2h 再灌注 6h 即 GRP78 蛋白表达,再灌注 12h 到达表达高峰, 24h 后表达开始减少;而各组脑缺血 2h 再灌注 6h 有少量 caspase-12 表达,随再灌注时间的延长表达量不断增长,再灌注 24h 到达表达高峰,48h 后表达开始减少。与 I/R 组比较,EA 组各时间点GRP78、caspase-12 蛋白表达下降(P<0.05)。
表 5 缺血 2h 再灌注各时间点 GRP78 蛋白表达(相对于β-action) (x±s,n=6)
Table 5 Comparison oftheexpressionofGRP78 at different time point after reperfusion(x±s,n=6)

注: 经统计学处理,与模型(I/R)对照组比较:: P△< 0.05, P*< 0.01。同一组别再灌注不同时间点比较: P&< 0.05, P#<0.01。
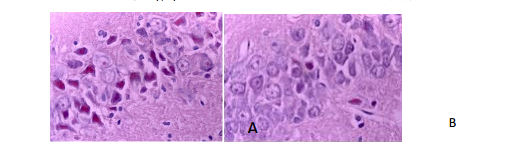
图 1 缺血 2h 再灌注 24h 海马 CA1 区神经细胞的 HE 染色(×630)
FIG. 1 HE staining of nerve cells in the hippocampal CA1 region of I/R,24h/2h(×630)
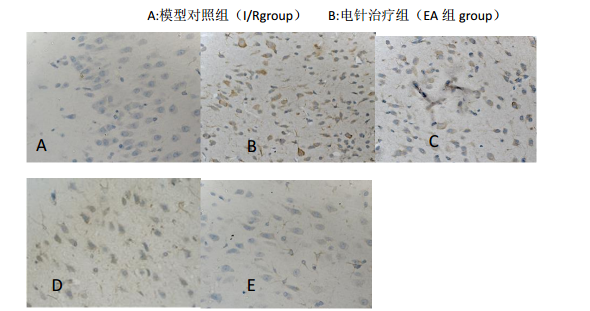
图 2 各组 GRP78 免疫阳性细胞表达(DAB×400)
FIG. 2Expression of GRP78 immune-positive cells in each group (DAB x 400)
注: A:假手术组(shamgroup) B:模型对照组缺血 2h 再灌注 12h (I/Rgroup,12h/2h) C:电针治疗组缺血 2h 再灌注 12h(EAgroup,12h/2h)
D: 模型对照组缺血 2h 再灌注 72h (I/R group, 72h/2h) E: 电针治疗组缺血 2h 再灌注 72h (EA group, 72h/2h)

图 4 各组 GRP78 蛋白印迹结果
FIG. 4 GRP78 proteinin each group

图 5 各组 caspase-12 蛋白印迹结果
FIG. 5Caspase-12 protein in each group
3. 讨 论
脑缺血再灌注是严重的应激条件,能够导致内质网应激而引发神经细胞凋亡[9]。Nakka 等[4]在局造性脑缺血再灌注模型中,观察到脑缺血再灌注损伤诱导内质网应激反应,内质网应激凋亡通路关键蛋白 caspase-12, GRP78 的表达会上调;实验进一步给予抑制剂抑制关键蛋白的活化,发现会减弱内质网应激反应,明显减轻脑缺血损伤,表现为脑梗塞面积减少,神经细胞凋亡减少。由此可见抑制内质网应激,保护内质网功能,是减轻脑缺血再灌注损伤的重要机制。张鸿等[10]通过免疫组化和 RT -PCR 方法发现大鼠脑缺血/再灌注后 caspase-12mRNA 及蛋白表达较假手术组均明显增高,而且其动态变化与神经元凋亡的演变规律基本一致,说明内质网信号通路参与了脑缺血后神经元凋亡的调控。
针刺作为中国传统治疗手法, 在脑缺血治疗及后遗症预防方面卓有成效,国内最早从细胞凋亡角度展开研究的见于 1998 年施静的报道[11], 随着神经分子生物学的发展, 针刺抗凋亡作用的机制已成为众多学者关注的焦点,现在研究表明:电针对脑缺血再灌注大鼠有脑保护作用,其机制可能是与通过提高 P53 蛋白、Bcl-2 蛋白等相关因子的表达和抑制 casepase-3 和 Bax 基因表达来调节细胞凋亡有关[12-13]。关于细胞信号通路的研究,陈氏等[14]研究发现电针刺激百会和大椎两穴可减轻大鼠脑缺血再灌注后神经细胞凋亡, 能刺激 PI3-K/Akt 信号通路的表达;罗氏等[15]研究认为针刺督脉治疗脑梗死,可能通过调节 FADD-Caspase-8 通路,减少脑细胞凋亡的发生,从而改善脑缺血再灌注损伤;但对针灸干预对脑缺血再灌注后内质网应激通路介导凋亡的研究尚未展开。本研究对脑缺血再灌注 6h、12h、24h、48h、72h 不同时间脑缺血区脑神经细胞损伤、凋亡及内质网应激凋亡通路信号分子 GPR78 和 caspase-12 进行了动态研究,并对比了电针的干预效应。研究发现,再灌注 6h 时间点有 TUNEL 阳性细胞出现,此时模型组在缺血半暗带区(IP 区)即有 GRP78 免疫阳性细胞表达,而此时 IP 区只有少量caspase-12 免疫阳性细胞出现;二者均随再灌注时间的延长表达不断增长, GRP78 再灌注 12h 到达表达高峰,24h 后表达开始减少,caspase-12 再灌注 24h 到达表达高峰,48h后表达开始减少,提示 caspase-12 的免疫活性出现的时间晚于 GRP78,结果与 Nakka 等[4]研究结果一致。以上研究显示,脑缺血再灌注引发神经元凋亡的高峰期在 24 小时,内质网应激凋亡通路的关键蛋白表达有先后,提示临床上对于脑卒中病人在有效时间窗内溶栓后应尽早(24h 内)实施抗凋亡治疗,以减轻脑缺血再灌注损伤;由于 caspase-12 的免疫活性出现的时间晚于 GRP78,基于临床用药实际,研制 caspase-12 抑制剂更有利用推广。在电针治疗组与模型对照组的比较中,我们发现电针治疗组对再灌注各时间点动物模型的神经学评分有不同程度的改善,再灌注 24h 组病理形态学观察,电针治疗组神经细胞损伤在形态学上有明显改善, 提示电针对脑缺血再灌注不同时间段所致损伤有改善的作用;进一步研究发现,电针治疗组的 GRP78、caspase-12 的表达变化趋势时间上与对照组相同,但在缺血再灌注 6h、12h、24h、48、72h,每个时间观察到的蛋白表达量均少于对照组(P<0.05, P<0.01) ,提示电针治疗对 GRP78、caspase-12 的释放和激活存在抑制作用, 电针可通过干预内质网介导的 caspase-12 依赖的细胞凋亡通路, 抑制细胞凋亡的发生。 提示临床上对于脑卒中的病人尽早使用电针有利于减少内质网应激,减轻脑缺血再灌注损伤。
综上所述,通过观察电针对脑缺血再灌注后不同时间所致脑缺血区神经细胞损伤、凋亡及凋亡信号关键分子的对比研究,我们发现电针对脑缺血再灌注后不同时间所致缺血脑神经细胞凋亡有减轻作用,对内质网应激介导的凋亡通路有干预作用,主要是通过抑制 GRP78、caspase-12 的释放和激活,降低凋亡率,发挥神经保护作用。这可能是针刺改善缺血再灌注损伤的部分作用机理。
参考文献
[1] Walter P, Ron D. The unfolded protein response: From stress pathway to homeostatic regulation[J].Science,2011,334(6059):1081-1086.
[2] Ito D, Suzuki N. Seipinopathy: a novel endoplasmic reticulum stress-associated disease [J].Brain,2009,132(Pt1):8-15.
[3] Kitamura M.Endoplasmic reticulum stress and unfolded protein response in renal pathophysiology Janus faces [J]. American JournalofPhysiology- Renal Physiology, 2008, 295(2):323-334.
[4] Nakka VP,Gusain A, Raghubir R. Endoplasmic reticulum plays critical role in brain damage after cerebral ischemia/reperfusion in rats [J]. Neurotoxicity Research, 2010,17(2):189-202.
[5] 刘青云,宋军,陈可冀.中药治疗缺血性中风的研究进展[J].中国中西医结合杂志, 2000; 20(4): 309-313.
[6]. Zea-Longa EZ, Weinstein PR, Carlson S, et al.Reversible middle cerebral artery occlusion without craniectomy in rats [J]Stroke,1989,20(2):84
[7]余曙光,徐斌主编.实验针灸学,第 1 版,人民卫生出版社,2012;269-272.
[8]徐叔云,卞如镰,陈修主编.药理学实验方法,第 3 版,人民卫生出版社,2002; 1066-1067.
[9] Morimoto N, Oida Y, Shimazawa M, et al. Involvement of endoplasmic reticulum stress after middle cerebral artery occlusion in mice [J] .Neuroscience,2007,147(4):957-967.
[10] 张鸿,宋利春,贾春红,等.大鼠脑缺血/再灌注后神经元凋亡及 caspase-12 mRNA 和蛋白表达的
改变[J].中国药理学通报,2008,24(8): 1069-1072.
[11] 施静,刘晓春,张静,等.电针对脑缺血神经元凋亡影响的形态学研究[J].中国组织化学与细胞化学杂志,1998, 7 (3): 391-396.
[12] 周红艳,范军铭,王军,等.电针对局灶性脑缺血大鼠海马神经细胞凋亡及 Bcl-2 、 Bax、 caspase-3 表达的影响[J].辽宁中医杂志,2009,36(8 ):1427-1429.
[13] 沈梅红,刘晓华,李缨,等.电针调节脑缺血再灌注大鼠大脑皮层 Bcl-2 和 Bax mRNA 的表达[J].辽宁中医杂志,2012,39(1):155-157.
[14] 陈东风,赖真,张少君等.电针刺激对大鼠脑缺血再灌注后 PI3-K/Akt 通路的影响[J]. 中国康复医学杂志,2009,24(6):502-504.
[15] 罗文舒,吴永刚,徐绍刚,等.针刺督脉对脑缺血再灌注大鼠 FADD-Caspase-8 通路的影响[J].中国医药指南,2012, 10 (3):319-321.

 世界针灸学会联合会
世界针灸学会联合会