基于Nrf2信号通路的电针对脑缺血再灌注模型小鼠细胞凋亡调节机制研究
方晨晨1,金晓露1,沈梅红1
(1南京中医药大学第二临床医学院,江苏南京 210023)
摘要:研究目的:进一步观察电针对脑缺血再灌注模型中细胞凋亡的保护作用,并探索Nrf2信号通路是否参与其中。研究方法:以野生型(WT)和Nrf2-/-(KO)小鼠为研究对象,按随机数字表分别随机分为电针组、模型组和假手术组3组,每组有效例数各30例。模型组和电针组采用改良Longa线栓法制备大脑中动脉缺血再灌注模型。电针组予以再灌注的同时,进行“百会”、“大椎”穴电针。针刺穴位深度为3mm-5mm,电针波形采用疏密波,频率为2/15 Hz,以针柄轻微颤动、穴区局部轻微抖动为度,连续治疗15 min。再灌注24h后采用Julio氏18分制评分法观察行为学评分、TTC染色法观察脑梗死体积、免疫组化法检测Bax和Bcl-2阳性细胞数量及平均光密度、qRT-PCR法检测mRNA含量等指标。数据采用SPSS23.0进行统计分析。研究结果:与相对应模型组比较,WT电针组行为学评分升高、脑梗死体积减小、Bax阳性细胞数和平均光密度、Bax mRNA含量降低,Bcl-2相应表达量升高,且均有统计学意义(P<0.05,P<0.01); KO电针组相应指标差异则无统计学意义。与WT电针组比较,KO电针组行为学评分降低、脑梗死体积增大、Bax阳性细胞数和平均光密度、Bax mRNA含量增高,Bcl-2相应表达量降低,且均有统计学意义(P<0.05,P<0.01)。结论:电针可通过降低Bax的表达,升高Bcl-2的表达从而抑制细胞凋亡的发生,减小梗死区域,提高神经功能评分,从而发挥电针对脑缺血再灌注损伤的达到脑保护的作用,其作用机制可能与Nrf2信号通路有关。
关键词:电针;脑缺血再灌注;Nrf2;细胞凋亡
Regulation mechanism of Electroacupuncture on apoptosis in mouse model of cerebral ischemia-reperfusion injury based on Nrf2 signaling pathway
FANG Chenchen1, JIN Xiaolu1, SHEN Meihong1
(1 Second Clinical Medical College, Nanjing University of Traditional Chinese Medicine, Nanjing Jiangsu 210023)
Abstract: Objective: Methods: Results: Conclusion:To explore whether the Nrf2 signaling pathway is involved in the protective effect of electroacupuncture through the apoptosis mechanism in cerebral ischemia-reperfusion model. Methods: Both wild type (WT) and Nrf2 knockout type (KO) mice were randomly divided into electrocardiographic group, model group and sham operation group. The number of effective cases in each group was 30 cases. In the model group and the electroacupuncture group, the right middle cerebral artery occlusion model was established by modified Longa suture method, 2h later ischemia reperfusion for 24h. Electroacupuncture group of mice tied to "Baihui", "Dazhui" with electro-acupuncture at the same time as the ischemia reperfusion. Cerebral ischemia and reperfusion were used to evaluate the functional activity of mice in accordance with Julio's neurobehavioral score. The volume of cerebral infarction was observed by TTC staining. Bax and Bcl-2 were detected by immunohistochemistry and image analysis system.And the mRNA expression of Bax and Bcl-2 were observed by RT-PCR. Results SPSS 23.0 was used for statistical analysis. Results: In the WT group, compared with the model group, the neurobehavioral scores are increased, the volume of cerebral infarction of the electroacupuncture group are decreased significantly (P <0.05),the number of Bax-positive cells and the average optical density decreased, the mRNA content decreased, the number of Bcl-2 positive cells and the average optical density increased, the mRNA content increased, the difference was statistically significant (P <0.05,P<0.01) .There was no significant difference in the eurobehavioral score, the infarct volume, Bax and Bcl-2 positive cells, mean optical density and mRNA content between the electroacupuncture group and the model group. There was no significant difference between the cerebral infarction volume and the number of Bax, Bcl-2 positive cells, the average optical density and mRNA contents between the WT model group and the KO model group. Compared with the KO electroacupuncture group, The number of Bax-positive cells ,the average optical density and the mRNA content decreased, while the Bcl-2 increased in the WT electroacupuncture group the differences were statistically significant(P<0.01). Conclusion: Electroacupuncture has a certain inhibitory effect on apoptosis, and its mechanism may be related to Nrf2 related pathways.
Key words: Electroacupuncture , Cerebral ischemia reperfusion , Nrf2 , Apoptosis
研究发现针刺能抑制Bcl-2家族中的具有促凋亡作用的Bax的表达,并能促进具有抗凋亡作用的Bcl-2的表达[1,2]。而Nrf2信号是近年国内外科学前沿最新发现的机体抵抗体内外氧化和化学等伤害性刺激的防御性转导通路之一[3]。课题组前期研究表明,电针可以调节脑缺血再灌注模型大鼠大脑皮层Nrf2蛋白的表达[4]。该因子不仅是细胞抗氧化反应的中枢调节者,研究亦认为其还可降低对凋亡信号的敏感性[5, 6]。那么,电针对脑缺血再灌注损伤中细胞凋亡的保护作用是否受到Nrf2信号通路的调节?本研究以野生型和Nrf2基因敲除小鼠分别制备脑缺血再灌注模型作为研究对象,探索Nrf2与神经元细胞凋亡之间的关系,为针刺治疗缺血性脑中风提供更丰富的实验依据。
1实验材料
1.1实验动物健康雄性野生型小鼠(WT)和Nrf2-/-型小鼠(KO),体重为28-32g,6-8周龄。分别由南京中医药大学动物实验中心和南京军区南京总医院提供。所有动物均饲养在清洁级的环境下,光照正常,饮水自由,环境温度25℃、湿度50~60%,空间内通风良好的动物房内。
1.2主要试剂及器材单克隆Bax一抗(货号:sc-7480,Santa公司);单克隆Bcl-2一抗(货号:sc-7382, Santa公司);SABC免疫组化染色试剂盒(武汉博士德生物试剂有限公司);RT-PCR反转录试剂盒(大连TaKaRa生物公司)。韩氏HANS-200型电针仪(南京济生医疗有限公司)、荧光多功能显微镜BX60(日本OLYMPUS公司);图像分析仪(CMIAS 98A,北京航空航天大学);Verity 96孔板热循环仪(美国Applied Biosystems公司);核酸蛋白检测仪(德国Eppendorf公司);PCR扩增仪7500(美国Applied Biosystems公司)等。
2实验方法
2.1实验分组和处理方法适应性喂养一周后,WT小鼠和KO小鼠均按随机数字表,各自随机分为假手术组、模型组和电针组,每组有效例数为30例。模型组和电针组小鼠在前期研究基础上采用改良Longa线栓法用φ0.128mm-0.148mm尼龙鱼线制作脑缺血2h再灌注24h模型。电针组在再灌注同时给予电针“百会”、“大椎”两穴进行治疗,针刺深度为3mm-5mm,电针波形采用疏密波,频率为2/15 Hz,以针柄轻微颤动、穴区局部轻微抖动为度,连续治疗15 min。其余步骤同课题组前期研究[4]。假手术组除不插入线栓外其余各步骤与模型组相同。
2.2 观察指标
2.2.1 神经行为学评分缺血2h再灌注24h后,采用Julio氏18分制评分法给予行为学评分。评分范围3~18分,18分为正常。
2.2.2 脑梗死体积采用TTC染色法,观察小鼠脑组织的缺血情况。再灌注24h后,迅速断头取脑,在冰上剥离后脑和嗅球,-20℃急冻10min后,平均切成6片,置于1%TTC溶液内37℃染色30min,4%多聚甲醛固定24h。相机拍照并用图像分析软件分析脑梗死体积百分比。
2.2.3 缺损侧大脑皮层Bax、Bcl-2蛋白表达采用免疫组化法检测[4]。小鼠经多聚甲醛灌注后取脑置于4℃的多聚甲醛溶液中,常规脱水、透明、包埋后切片,每只动物取2张切片按Bax、Bcl-2蛋白免疫组化试剂盒说明书进行操作。显微镜400倍视野下随机选择不重叠缺损侧皮层5个视野观察Bax、Bcl-2的阳性细胞表达,取其均值,并用图像分析软件计算阳性细胞的平均光密度值。
2.2.4 缺损侧大脑皮层Bax、Bcl-2 mRNA采用qRT-PCR法进行检测[4]。小鼠处死后,在冰盘上迅速分离梗死侧皮层,液氮速冻保存。经总RNA提取,逆转录合成cDNA后,以GAPDH为内参,进行PCR扩增40个循环,最后读取荧光强度。
2.3统计学方法采用SPSS 23.0进行统计分析。对各组数据采用单因素方差分析AVONA检验方法,其中方差齐性采用LSD检验,方差不齐采用Tamhane’s检验。检验结果以P<0.05为有统计学差异,P<0.01为有显著统计学差异。所有数据均采用(± s)的表达形式。
3结果
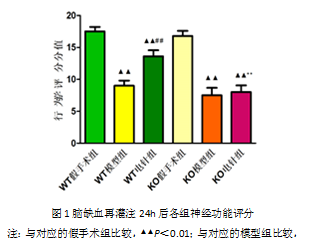
3.1电针对脑缺血再灌注小鼠神经行为学功能评分的影响
与对应假手术组相比,WT模型组、KO模型组和KO电针组神经功能评分均显著降低(P<0.01),WT电针组亦明显低于假手术组(P<0.05)。与对应的模型组相比,WT电针组评分明显升高,而KO电针组无明显变化。WT电针组评分明显高于KO电针组(P<0.05),结果见图1。
3.2小鼠脑缺血再灌注脑组织梗死情况(TTC染色)
由图2、3可知,小鼠再灌注24h后,假手术组TTC染色见均质红染;模型组与电针组右侧可见大小不一的白色梗死区域。与相对应的模型组比较,WT电针组脑梗死体积显著减小,KO电针组脑梗死体积变化不明显。与WT电针组比较,KO电针组梗死体积显著增大。

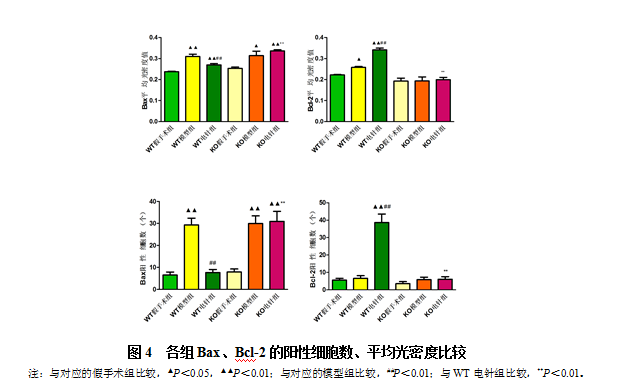
3.3小鼠缺血侧大脑皮层Bax、Bcl-2阳性细胞数及蛋白表达情况
400倍显微镜下观察免疫组化染色结果发现,Bax、Bcl-2的阳性细胞胞浆呈黄色或棕黄色。从图4可见,与相对应的假手术组比较,WT模型组、KO模型组和KO电针组中Bax阳性细胞数和平均光密度均升高(P<0.05,P<0.01),WT电针组升高不明显; WT电针组Bcl-2阳性细胞数显著升高(P<0.01)。与对应的模型组比较,WT电针组Bax阳性细胞数和平均光密度均明显降低,Bcl-2表达显著升高(P<0.01),而KO电针组则没有明显改变;与WT电针组相比,KO电针组Bax阳性细胞数和平均光密度均显著升高,Bcl-2显著降低(P<0.01)。
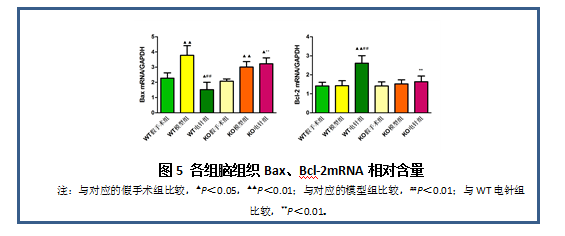
3.4小鼠脑缺血再灌注缺损侧脑组织Bax、Bcl-2 mRNA表达情况
从图5可知,与相对应的假手术组比较,WT模型组和KO模型组中Bax mRNA表达均显著增多(P<0.01),KO电针组表达明显升高(P<0.05),WT电针组明显减少(P<0.05); WT电针组Bcl-2表达量显著升高(P<0.01)。与对应的模型组比较,WT电针组Bax mRNA表达量显著下降,Bcl-2 mRNA表达量显著升高(P<0.01),而KO电针组改变不明显;与WT电针组相比,KO电针组Bax mRNA表达量显著升高,Bcl-2mRNA表达量则显著降低(P<0.01)。
4讨论
细胞凋亡是一种在生理或病理条件下的,受多种基因调控的,主动的、程序化的死亡过程。关于细胞凋亡,目前研究的最多的是Bcl-2和Bax基因。其中,Bcl-2基因被认为是抗凋亡基因的成员代表,定位于线粒体外膜上的该基因可以通过抑制机体的氧化还原状态从而阻止细胞凋亡的发生[7]。而Bax基因则被认为可以破坏线粒体膜的完整性,并与Bcl-2基因对抗,从而发挥其凋亡的作用。生理状态下,Bax和Bcl-2蛋白在机体内维持一个相对平衡的状态,使机体保持着活跃的新陈代谢。脑缺血再灌注早期由于脑部组织瞬时间缺血缺氧,机体发生氧化应激反应,定位于线粒体膜上的Bcl-2和Bax基因调控紊乱,Bax基因大量表达,Bcl-2受到抑制,从而诱导神经元细胞出现凋亡[8]。同时脑组织因缺血缺氧产生过量的ROS,损伤细胞内线粒体,也能诱导凋亡发生[9-11],导致脑缺血早期的神经细胞的损伤。
电针/针刺对Bcl-2、Bax有一定的调节作用[12]。本课题组的前期研究亦证实电针可能是通过下调促凋亡基因Bax mRNA的表达、升高Bcl-2 mRNA/Bax mRNA的比值从而形成以Bcl-2占优势的Bax/Bcl-2二聚体来减轻脑缺血再灌注损伤从而达到保护受损的神经元的作用[13]。Nrf2是机体内关键性抗损伤因子,具有抗细胞凋亡的作用。我们在此基础上,采用野生型、Nrf2-/-小鼠分别制备脑缺血再灌注模型,对比观察发现电针“百会”、“大椎”穴可明显改善野生型小鼠的神经评分,减轻梗死区域,但对Nrf2-/-小鼠作用不明显,表明Nrf2信号通路在电针对脑缺血再灌注损伤的神经保护作用中具有重要作用。
许多研究表明,电针/针刺可以从抗氧化应激[14]、对抗细胞凋亡[12]、抑制炎症反应[15]、促血管再生、抑制兴奋性氨基酸的神经毒性等多方面、多途径对脑缺血再灌注损伤进行综合调理。本研究发现,在WT小鼠中,电针组与模型组相比较,电针组Bcl-2 mRNA及蛋白表达均明显增高,Bax表达明显降低,说明电针有抑制凋亡的效果,这与我们前期的研究结果相符合[4,16],也与相关文献报道[17]结果一致;但在KO小鼠中,电针组与模型组相比较,神经行为学评分、脑梗死体积、Bcl-2、Bax mRNA及蛋白表达均无差异;而WT电针组与KO电针组相比较,WT电针组神经行为学评分升高、脑梗死体积减小、Bax蛋白表达及mRNA含量降低,Bcl-2蛋白表达及mRNA含量升高,且差异均有统计学意义,说明电针对脑缺血再灌注损伤的脑保护作用有可能与Nrf2信号途径有关。结合前期研究推测其机制可能是电针通过调节Nrf2信号通路,降低Bax的表达,升高Bcl-2的表达从而抑制细胞凋亡的发生,减小梗死区域,提高神经功能评分,从而发挥电针对脑缺血再灌注损伤的脑保护的作用。
参考文献
1] 范茜茜,董勤,沈梅红,等. 电针对大鼠脑缺血再灌注损伤后细胞凋亡相关基因Bcl-2、Bax表达的影响[J]. 中国老年学杂志. 2017(05): 1041-1043.
[2] 樊凌,吕爱平,符文彬,等. 针刺对抑郁症大鼠海马5-HT、NE、BDNF水平和神经元细胞凋亡相关基因表达的影响[J]. 中华中医药杂志. 2016(08): 3204-3207.
[3] Huang J Y, Yuan Y H, Yan J Q, et al. 20C, a bibenzyl compound isolated from Gastrodia elata, protects PC12 cells against rotenone-induced apoptosis via activation of the Nrf2/ARE/HO-1 signaling pathway[J]. Acta Pharmacol Sin. 2016, 37(6): 731-740.
[4] 沈梅红,沈洁,舒兆瑞,等. 电针调节脑缺血再灌注模型大鼠大脑皮层Nrf2蛋白的表达[J]. 中国老年学杂志. 2014(24): 6989-6991.
[5] Khalifeh S, Oryan S, Digaleh H, et al. Involvement of Nrf2 in development of anxiety-like behavior by linking Bcl2 to oxidative phosphorylation: estimation in rat hippocampus, amygdala, and prefrontal cortex[J]. J Mol Neurosci. 2015, 55(2): 492-499.
[6] Wang Y, Zhang Z, Guo W, et al. Sulforaphane reduction of testicular apoptotic cell death in diabetic mice is associated with the upregulation of Nrf2 expression and function[J]. Am J Physiol Endocrinol Metab. 2014, 307(1): E14-E23.
[7] 董雅洁,高维娟. bcl-2、bax、caspase-3在细胞凋亡中的作用及其关系[J]. 中国老年学杂志. 2012(21): 4828-4830.
[8] 陈锋,阳生光,李建军,等. 血塞通对全脑缺血/再灌注后大鼠海马回中Bcl-2及Bax的影响[J]. 临床医学工程. 2015(11): 1426-1428.
[9] Rajendran P, Nandakumar N, Rengarajan T, et al. Antioxidants and human diseases[J]. Clin Chim Acta. 2014, 436: 332-347.
[10] Wang Y, Wang W, Wang N, et al. Mitochondrial Oxidative Stress Promotes Atherosclerosis and Neutrophil Extracellular Traps in Aged Mice[J]. Arterioscler Thromb Vasc Biol. 2017, 37(8): e99-e107.
[11] Dai D F, Chiao Y A, Marcinek D J, et al. Mitochondrial oxidative stress in aging and healthspan[J]. Longev Healthspan. 2014, 3: 6.
[12] 侯志涛,孙忠人,刘松涛,等. 电针对缺血性学习记忆障碍大鼠氧自由基及凋亡相关蛋白表达的影响[J]. 针刺研究. 2015(06): 431-438
[13] .沈梅红,刘晓华,李缨,等. 电针调节脑缺血再灌注大鼠大脑皮层Bcl-2和Bax mRNA的表达[J]. 辽宁中医杂志. 2012(01): 155-157.
[14] 李静,王丽娜,肖红玲,等. 电针对帕金森病大鼠中脑黑质多巴胺能神经元氧化应激损伤的影响[J]. 针刺研究. 2014(03): 185-191.
[15] 姚建宁,王鲜,柳维林,等. 电针激活大脑中动脉闭塞大鼠miRNA调控NF-κB信号通路的机制研究[J]. 中国康复医学杂志. 2016(04): 388-393.
[16]Shen M H, Zhang C B, Zhang J H, et al. Electroacupuncture Attenuates Cerebral Ischemia and Reperfusion Injury in Middle Cerebral Artery Occlusion of Rat via Modulation of Apoptosis, Inflammation, Oxidative Stress, and Excitotoxicity[J]. Evid Based Complement Alternat Med. 2016, 2016: 9438650.
[17] 陶静,陈阿贞,兰岚,等. 电针对大鼠早期局灶性脑缺血再灌注损伤细胞凋亡机制的研究[J]. 中国康复医学杂志. 2014(01): 3-8.

 世界针灸学会联合会
世界针灸学会联合会