夹脊电针对急性脊髓损伤大鼠运动功能及脊髓组织NogoA、RhoA、ROCKⅡ蛋白表达的影响
吴 磊1,李晓宁2,覃业校2,梁雪松1,单筱淳1,梅继林1,李 诺1
(1黑龙江中医药大学,哈尔滨150001;2黑龙江中医药大学附属第二医院针灸科四病房,哈尔滨150001)
摘要:目的:观察夹脊电针对急性脊髓损伤模型大鼠肢体运动功能和脊髓组织髓鞘相关抑制因子勿动蛋白A(Nogo-A)、Ras同源基因家族成员A(RhoA)和Rho激酶Ⅱ(ROCK Ⅱ)蛋白表达的影响,探讨夹脊电针治疗急性脊髓损伤的作用机制。方法:18只雌性Wistar大鼠随机分为假手术组、模型组和夹脊电针组,每组6只。采用NYU打击器制备急性脊髓损伤模型,夹脊电针组给予损伤节段上下一对夹脊穴电针治疗,每日1次,每次30 min,连续治疗28 d。治疗1d、3d、7d、14d、28d后采用BBB评分法对大鼠急性脊髓损伤后运动功能进行评估;治疗28d后采用HE染色观察脊髓组织病理形态学变化;治疗28d后采用Western blot法检测脊髓组织Nogo-A、RhoA和ROCK Ⅱ蛋白表达。结果:与假手术组比较,模型组和针刺组在各时间点BBB评分显著降低(P<0.05),此后评分逐渐升高;与模型组比较,夹脊电针组在治疗3d后BBB评分显著升高(P<0.05)。HE染色结果可见,假手术组大鼠脊髓组织结构完整,模型组脊髓组织被严重破坏,可见空洞形成,神经细胞数量减少,胶质细胞和炎性细胞浸润;夹脊电针组脊髓组织结构尚可,神经细胞数量较模型组增多,炎性细胞较模型组减少。与假手术组比较,模型组Nogo-A、RhoA和ROCK Ⅱ蛋白表达均显著升高(P<0.05);与模型组比较,夹脊电针组Nogo-A、RhoA和ROCK Ⅱ蛋白表达均显著降低(P<0.05)。结论:夹脊电针治疗能够显著改善急性脊髓损伤模型大鼠肢体运动功能和脊髓组织病理形态学变化,可能与其下调脊髓损伤微环境中Nogo-A、RhoA、ROCKⅡ蛋白表达有关。
关键词:针灸推拿学;夹脊电针;急性脊髓损伤;运动功能;勿动蛋白A
Effect of Jiaji Electroacupuncture on Motor Function and NogoA, RhoA and ROCKⅡ Protein Expression in Spinal Cord Tissue of Rats with Acute Spinal Cord Injury
WU Lei1, LI Xiao-ning2, QIN Ye-xiao2, LIANG Xue-song1,SHAN Xiao-chun1, MEI Ji-lin1,LI Nuo1.
(1Heilongjiang University of Chinese Medicine, Harbin 150001,China; 2Second Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin 150001)
ABSTRACT: Objective:To observe the effect of Jiaji electric acupuncture on limb motor function and myelin-related inhibitory factor Nogo-A and RhoA, ROCK Ⅱ protein expression in rats with acute spinal cord injury. To explore the mechanism of Jiaji electric acupuncture in the treatment of acute spinal cord injury. Methods: Eighteen Wistar rats were randomly divided into sham operation group, model group and Jiaji electric acupuncture group. The model of acute spinal cord injury was made by NYU striker. The electric acupuncture group was treated with electroacupuncture at the upper and lower points of the injury section. The treatment was repeated for 28 days. The motor function of acute spinal cord injury was evaluated by BBB score at 1d, 3d, 7d, 14d and 28d. The pathological changes of spinal cord were observed by HE staining after 28 days of treatment. After 28 days of treatment, Tissue expression of Nogo-A, RhoA and ROCK Ⅱ proteins. Results:Compared with the sham group, the BBB score of the model group and the acupuncture group decreased significantly at each time point (P <0.05), and then the score increased gradually. Compared with the model group, the BBB score was significantly increased High (P <0.05). HE staining results showed that the spinal cord tissue of the sham operation group was intact and the spinal cord tissue in the model group was severely damaged, showing the formation of voids, the decrease of the number of nerve cells, the glial cell and inflammatory cell infiltration; the spinal cord tissue structure The number of nerve cells was higher than that of the model group, and the number of inflammatory cells was lower than that of the model group. Compared with the sham group, the expression of Nogo-A, RhoA and ROCK Ⅱ protein in the model group were significantly higher than those in the sham group (P <0.05). Compared with the model group, the expression of Nogo-A, RhoA and ROCK Ⅱ (P <0.05). Conclusion:Jiaji electroacupuncture can significantly improve the limb motor function and pathological changes of spinal cord in rats with acute spinal cord injury, which may be related to the down-regulation of Nogo-A, RhoA and ROCKⅡ protein expression in spinal cord injury microenvironment.
Keywords:Acu-moxibustion and Tuina,Jiaji electroacupuncture, Acute spinal cord injury, Motor function, Nogo-A
急性脊髓损伤是由于脊髓遭受暴力损伤后出现局部出血、水肿,继而引起受损脊髓组织内神经细胞凋亡、坏死,使神经系统功能受到破坏[1]。急性脊髓损伤的发病率为每年10.4-83.0/100万,并有逐渐上升的趋势[2]。在我国,急性脊髓损伤发病总人数逐年增加,住院死亡率较高,脊髓损伤后神经功能恢复一直是脊柱外科和神经科学研究的热点和难点[3]。近年来研究发现,急性脊髓损伤后微环境中髓鞘相关抑制因子的大量释放是导致轴突不能有效再生的主要原因[4]。Nogo是一种在中枢神经系统广泛表达的能够和中枢髓磷脂结合的特异性的抑制因子,其中,Nogo-A被认为是近年来发现的对中枢神经系统中神经纤维再生抑制作用最强的抑制因子[5]。在脊髓损伤后,Nogo-A和其受体结合,进而启动信号级联反应并传导到神经细胞生长锥,引起生长锥内的丝状伪足收缩,破坏生长锥的形态和功能的稳定性,并最终导致生长锥的塌陷[6]。Lehmann 等研究发现[7],神经细胞生长锥的塌陷受GTP酶RhoA及其下游信号分子的调控,RhoA和ROCK Ⅱ被认为是细胞骨架维持稳定的重要调节剂之一,可能参与了急性脊髓损伤后微环境继发性损伤机制。
夹脊电针疗法是在传统针灸疗法的基础上发展而来,具有适应症广泛、操作简便、安全有效等优点,临床用以治疗多种疾病。研究表明[8-9],夹脊电针治疗能够显著改善脊髓损伤患者肢体运动功能,其作用机制与改善脊髓损伤后微环境变化有关,然而其对急性脊髓损伤后微环境Nogo-A、RhoA和ROCK Ⅱ蛋白表达的影响尚未阐明。本研究通过建立急性脊髓损伤大鼠模型,观察夹脊电针对大鼠肢体运动功能及脊髓组织Nogo-A、RhoA和ROCK Ⅱ蛋白表达的影响,探讨夹脊电针治疗急性脊髓损伤的作用机制。
1 材料与方法
1.1实验动物与分组
健康清洁级雌性Wistar大鼠,体质量(200±10)g,由辽宁长生生物技术有限公司提供,动物许可证号:2015-0001。饲养环境为:室温23°C-25°C,湿度40%-60%,12 h明暗交替,每笼5只,自由进食水。大鼠适应性饲养1周,造模前24 h禁食,不禁水。实验过程中,严格按照国际最新的实验动物使用指南,并给予充分的关怀,严格按照指南标准进行。将18只大鼠编号后随机分为假手术组、模型组和夹脊电针组,每组6只大鼠。
1.2主要试剂与仪器
抗Nogo-A抗体(D 261039,上海生工,中国);抗RhoA抗体(10749-1-AP ,Proteintech,英国);抗ROCK Ⅱ抗体(WL 00550,wanleibio,中国);BCA蛋白浓度测定试剂盒(WLA 004,wanleibio,中国);PVDF膜(IPVH 00010,Millipore,美国)。酶标仪(ELX-800,BIOTEK,美国);电热恒温培养箱(DH 36001 B,天津泰斯特,天津); 双垂直蛋白电泳仪(DYCZ-24 DN,北京六一,北京);凝胶成像系统(WD-9413 B型,北京六一,北京);超速冷冻离心机(H-2050 R,湖南湘仪,长沙);电针仪(KWD-808Ⅱ,英迪,中国);针灸针(0.30 mm×16 mm,华佗,中国)。
1.3模型制备及评定标准
参考Basso等[10]及前期研究[11]制备急性脊髓损伤大鼠模型。造模前大鼠禁食24 h,以防术后严重肠梗阻,大鼠称重后以10%水合氯醛腹腔注射麻醉(3.5 mL/kg)。待大鼠完全麻醉后俯卧固定四肢及头部,以T10棘突为中心备皮、消毒后行纵行切口,长约30 mm,依次暴露棘突、椎板和脊髓后,用NYU打击器撞击T10节段脊髓,高度为50 mm。撞击完成后可见打击器发出撞击完成的警报声,与打击器连接的电脑软件描记出撞击曲线,撞击高度和速度误差在正常范围内,撞击瞬间可见大鼠身体痉挛性抽动,移开打击棒可见撞击局部脊髓充血,视为撞击成功。用无菌生理盐水冲洗伤口并清除残留血液,逐层缝合。待大鼠苏醒后运用BBB评分观察大鼠后肢运动情况,大鼠BBB评分在1-3分视为造模成功,其中,1分表现为大鼠后肢仅有一个或者两个关节轻微的活动,通常为髋和/或膝关节;2分表现为大鼠后肢有一个关节广泛的活动或一个关节广泛活动且有另一关节轻微活动;3分表现为大鼠后肢有两个关节广泛活动。术后每日2次按摩大鼠下腹部促进排尿,直至大鼠恢复自主排尿为止。
假手术组仅暴露脊髓但不撞击,其余操作相同。术后常规饲养,室温维持在23~25 ℃,自由进食、水,每2日更换垫料。
1.4干预方法
假手术组:暴露脊髓后不加以任何干预及撞击,术后常规饲养,保证充分粮食和水,不予任何处置
模型组:造模成功后采取单笼独立饲养,不予任何处置。
夹脊电针组[12]:模型制备成功后3 h采用夹脊电针治疗,每日1次,每次30 min。选取T9、T11节段夹脊穴,将0.35 mm×13 mm毫针直刺入所选穴位下4-5 mm,接通电针仪,同侧正极在上、负极在下,电流输出强度以大鼠耐受、不出现强烈挣扎、背部肌肉轻微抽动为度。电针仪脉冲波型:密波,频率为100 Hz。每次30 min,每日1次,连续治疗28天。
1.5观察指标及检测方法
BBB评分及取材:采用Basso、Beattie和Bresnahan(BBB)评分法观察各组大鼠运动功能恢复情况:各组大鼠治疗后,将大鼠放置于一1.00×1.00 m2的空地上自由活动,每只大鼠每次活动3 min,由2位在实验开始前经过培训但不熟悉实验设计及各组大鼠分组情况的人员观察大鼠的髋、膝、踝关节行走,躯干运动及协调情况,判断损伤大鼠BBB评分。各组大鼠治疗28 d后行BBB评分后,以10%水合氯醛腹腔注射麻醉(3.5 mL/kg),于冰盒上快速取出损伤处脊髓,以损伤中心为中点,长度约10 mm,从损伤中心处切开,分别置于4%多聚甲醛溶液和-80℃冰箱中保存备用。
HE染色步骤:取固定好的脊髓组织,经梯度酒精脱水后用石蜡包埋,制备石蜡切片(层后5μm),再经切片脱蜡至水、染色、透明和封片等步骤,观察脊髓组织形态学变化。
Western blot检测:取一定量样本加入相应体积的裂解液,置于冰上孵育5 min,开启低温冷冻离心机,12 000 r/min,4℃,离心10 min,取上清液。BCA法测定蛋白质浓度,上样体积20 μl,含40 μg蛋白。10% SDS-PAGE电泳,电压80 V,恒压电泳2.5 h,电转膜至PVDF膜。一抗1:500稀释后4℃过夜,孵育结束后TBST漂洗,二抗1:5 000稀释后37℃孵育45min,二抗孵育结束后PVDF浸入TBST中,摇床摇动5min,重复6次。滴加ECL发光液,室温静置反应5min,凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带和β-actin的光密度值,以目标条带/β-actin条带作为该样品目的蛋白相对表达量。
1.6统计学处理
采用SPSS19.0软件进行统计学分析,BBB评分和Nogo-A、RhoA和ROCK Ⅱ蛋白的相对表达量以均数±标准差(±s)表示,组间比较采用单因素方差分析,多重比较用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1夹脊电针对急性脊髓损伤大鼠肢体运动功能的影响
假手术组BBB评分均为21分;与假手术组比较,模型组和针刺组在各时间点BBB评分显著降低(P<0.05),大鼠出现严重的肢体运动功能障碍,此后评分逐渐升高;与模型组比较,夹脊电针组在治疗3d后BBB评分显著升高(P<0.05)。见图1。
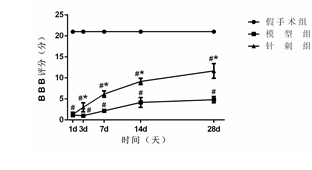
图1 各组大鼠BBB评分结果比较(±s,6只鼠/组)
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05。
2.2 夹脊电针对急性脊髓损伤大鼠脊髓组织病理形态学的影响
假手术组大鼠脊髓组织结构完整,神经细胞形态完好,胞体圆润,胞核呈蓝色,偶见深色核仁。模型组脊髓组织被严重破坏,可见空洞形成,神经细胞数量减少,残存的神经细胞胞体肿胀变形,可见较多胶质细胞和炎性细胞浸润。夹脊电针组脊髓组织结构尚可,神经细胞数量较模型组增多,神经细胞形态尚可,胞体圆润,炎性细胞较模型组减少。见图2。
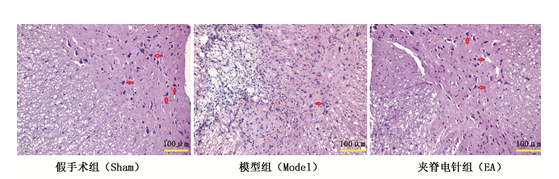
图2 各组大鼠脊髓组织形态学改变(HE染色,×200,图中箭头所示为神经细胞)
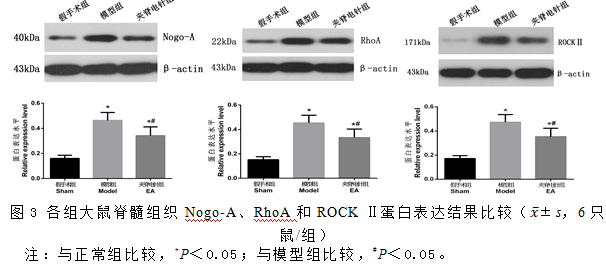
2.3夹脊电针对急性脊髓损伤大鼠脊髓组织Nogo-A、RhoA和ROCK Ⅱ蛋白表达的影响
假手术组大鼠脊髓组织Nogo-A、RhoA和ROCK Ⅱ蛋白少量表达;与假手术组比较,模型组大鼠脊髓组织Nogo-A、RhoA和ROCK Ⅱ蛋白表达显著升高(P<0.05);与模型组比较,夹脊电针组大鼠大鼠脊髓组织Nogo-A、RhoA和ROCK Ⅱ蛋白表达显著降低(P<0.05)。见图3。
3 讨论
脊髓损伤属于中医“痿病”范畴,历代医家对其病因病机多有论述,但概括起来其基本病机不外“督脉损伤,枢机不利,阴阳失调”。督脉为人体阳脉之海,膀胱经为多气多血之经,且与督脉相邻,因此临床治疗脊髓损伤所致截瘫多以调节督脉和膀胱经经气为主。夹脊穴与督脉和膀胱经临近,临床操作时针尖向脊柱方向斜刺进针,能够调节足太阳膀胱经、督脉、夹脊穴经气,起到一针透三穴的作用,因而具有单独针刺督脉和膀胱经穴所不具有的优势,通过针刺夹脊穴并配合电针能够疏通督脉和膀胱经经气,通调一身之阳气,使全身气血流畅。现代医学研究发现,夹脊穴深部为脊神经支走行,针刺以及电针可以调节神经根兴奋性,从而改善脊髓损伤肢体功能恢复[13]。课题组前期研究表明[14],夹脊电针能够减轻脊髓损伤患者肢体痉挛、提高下肢运动功能,从而改善其日常生活活动能力,通过本研究也发现,夹脊电针能够显著提高ASCI模型大鼠BBB评分,恢复肢体运动功能。
急性脊髓损伤后肢体运动功能的恢复有赖于受损神经细胞轴突再生,急性脊髓损伤后,局部微环境中产生多种抑制轴突再生的不利因素,主要包括内源性和外源性两大类。内源性因素主要是由于中枢神经系统本身缺乏轴突再生的内源性能力,当脊髓损伤发生后,受损的神经细胞难以维持轴突的不断再生以完成神经功能重建。外源性因素中由于髓鞘相关抑制因子(MAIF)的存在[15]被认为是轴突再生失败的主要原因。髓鞘相关抑制因子包括髓鞘相关糖蛋白(MAG),Nogo-A 和少突胶质细胞髓鞘糖蛋白(OMgp),通过完整的少突胶质细胞和髓鞘分泌,这些髓鞘相关抑制因子通过勿动蛋白(Nogo)受体与NgR/p75 NTR 受体复合物结合,激活一系列下游级联反应,引起生长锥变性,最终导致神经轴突萎缩和轴突再生的失败。尹明锡等[16]研究发现,Nogo-A在正常大鼠脊髓组织中表达较低,在ASCI后大鼠损伤区域开始大量表达,随着时间的增多,Nogo-A表达量升高。朱枫[17]等同时研究发现,以Nogo-A为代表的MAIF能够通过活化Rho,激活ROCKⅡ,引起肌动蛋白细胞骨架重组,最终导致生长锥塌陷和轴突再生障碍,而给予ROCKⅡ特异性抑制剂法舒地尔可以促进脊髓损伤大鼠损伤局部神经纤维再生,可能机制是通过下调脊髓损伤大鼠脊髓组织RhoA mRNA的表达有关[18]。本研究显示,脊髓损伤后脊髓微环境中Nogo-A、RhoA和ROCK Ⅱ蛋白表达显著升高,脊髓损伤后28天仍有较高表达,说明脊髓损伤后过度释放Nogo-A能够激活RhoA/ROCK Ⅱ信号通路,引起下游级联反应,可能是损伤神经细胞轴突再生失败的关键因素之一,而夹脊电针治疗可以显著抑制Nogo-A、RhoA和ROCK Ⅱ蛋白表达,与模型组比较差异显著,可能参与了夹脊电针促进轴突再生及肢体运动功能恢复的过程,与BBB评分结果一致。尤武林等[19]运用脊髓康治疗急性脊髓损伤大鼠,结果表明脊髓康能够促进神经细胞再生,可能是通过调节Nogo-A及其受体的基因表达发挥作用。姚年伟[20]研究发现,丹参酮IIA能够抑制ASCI后RhoA基因和蛋白表达,从而发挥脊髓损伤后神经保护功能。上述结果与本研究结果一致。
综上所述,夹脊电针治疗能够显著改善急性脊髓损伤模型大鼠肢体运动功能,可能与其下调脊髓损伤微环境中Nogo-A、RhoA和ROCK Ⅱ蛋白表达,促进轴突再生有关。
参考文献
[1] 吕威,李冰,景泉凯,等. 电针“大椎”“命门”对脊髓损伤大鼠神经元细胞凋亡及JNK信号通路相关蛋白表达的影响[J]. 针刺研究,2017,42(01):14-19.
[2] JAIN NB,AYERS GD,PETERSON EN,et al. Traumatic spinal cord injury in the United States, 1993-2012[J]. JAMA,2015,313(22):2236-43.
[3] 李华南,张海明,顾兵,等. 针刺促进脊髓损伤后神经功能恢复的机制及相关信号通路的作用[J]. 中国康复理论与实践,2017,23(06):641-644.
[4] FUJITA Y,YAMASHITA T. Axon growth inhibition by RhoA/ROCK in the central nervous system [J]. Front Neurosci,2014,08(338):1-12.
[5] 吴锋,李怀斌,赵健,等. 电针结合天麻素对局灶性脑缺血大鼠神经功能、额叶皮质勿动蛋白A及其受体表达的影响[J]. 针刺研究,2016,41(01):65-69.
[6] MONNIER PP,SIERRA A,SCHWAB JM,et al. The Rho/ ROCK pathway mediates neurite growth inhibitory activity associated with the chondroitin sulfate proteogly cans of the CNS glial scar[J]. Mol Cell Neu rosci,2003,22(03):319-330.
[7] LEHMANN M,FOURNIER A,SELLES-NAVARRO I,et al. Inactiviation of Rho signaling pathway promotes CNS axon regeneration[J]. J Neurosci,1999,19(17):7535-7547.
[8] 李晓宁,迟蕾. 夹脊配合督脉电针治疗脊髓损伤后功能障碍临床观察[J]. 上海针灸杂志,2015,34(10):972-975.
[9] 李晓宁,张良,杨庆红,等. 夹脊电针对脊髓损伤后大鼠c-fosmRNA及BNIP3 mRNA表达影响的实验研究[J]. 针灸临床杂志,2015,31(07):83-86.
[10] BASSO DM,BEATTIE MS,BRESNAHAN JC. Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J]. Exp Neurol,1996,139(02):244-256.
[11] 李晓宁,吴磊,迟蕾,等. 不同治疗周期夹脊电针对急性脊髓损伤大鼠运动功能及细胞凋亡的影响[J]. 针刺研究,2016,41(06):492-496.
[12] 李晓宁,吴磊,梅继林,等. 夹脊电针联合甲强龙对急性脊髓损伤大鼠肢体运动功能及尼氏小体影响的实验研究[J]. 针灸临床杂志,2016,32(12):61-64+91.
[13] 胡华辉,黄小龙,刘飞,等. 电针夹脊穴治疗脊髓损伤机制的实验研究进展[J]. 上海针灸杂志,2016,35(12):1480-1483.
[14] 霍会霞. 头电针配合夹脊电针治疗脊髓损伤后下肢运动功能障碍的临床观察 [D].黑龙江中医药大学,2014.
[15] SCHWAB M E. Repairing the injured spinal cord [J]. Science,2002,295(5557):1029 -1031.
[16] 尹明锡,时素华,宋萌. 电针对大鼠脊髓损伤后Nogo-A表达的实验研究[J]. 陕西中医,2010,31(03):371-373.
[17] 朱枫,鲁秀敏,王永堂. 中枢神经再生抑制因子及免疫治疗研究[J].现代生物医学进展,2008,08(09):1743-1745.
[18] WU BQ,BI ZG,QI Q. Inactivation of the Rho-ROCK signaling pathway to promote neurologic recovery after spinal cord injuries in rats [J]. Chin Med J (Engl),2013,126(19):3723-3727.
[19] 尤武林,张亚峰,陈剑峰,等. 中药脊髓康对脊髓损伤大鼠Nogo-NgR基因表达的影响[J]. 中国骨伤,2015,28(03):235-239.
[20] 姚年伟. 丹参酮IIA对大鼠急性脊髓损伤保护作用及其机制研究[D].湖北中医药大学,2016.

 世界针灸学会联合会
世界针灸学会联合会