夹脊电针对兔退变腰椎间盘Actin、Tubulin表达的影响
李妍玲1,邹 璟2,黄国付3
(1. 湖北中医药大学针灸骨伤学院,湖北省 武汉市,430065;2.武汉市中西医结合医院,湖北省 武汉市,430022;3.武汉市武昌医院,湖北省 武汉市,430063)
摘要:目的:观察夹脊电针对兔腰退变椎间盘肌动蛋白(actin)、微管结合蛋白(tubulin)表达的影响,探讨夹脊电针防治腰椎间盘退变的作用机制。方法:40只新西兰大白兔分为正常组、模型组、假模型组、电针组4组,每组各10只。模型组采用轴向加压法建立腰椎间盘退变模型,电针组给予L4、L5双侧夹脊穴电针治疗28天。各组于术后第28天和56天取出椎间盘组织,通过Western blot检测不同时间点椎间盘细胞中actin、tubulin的表达。结果:模型组术后第28天、第56天及电针组术后第28天actin、tubulin表达与正常组及假模型组术后第28天、第56天相比均有明显下降(P<0.05);电针组经电针治疗28天后actin、tubulin表达与该组术后第28天及模型组术后第56天相比均有明显升高(P<0.05)。结论:电针可通过上调模型兔退变腰椎间盘细胞中actin、tubulin的表达,促进退变腰椎间盘细胞骨架恢复,从而起到延缓椎间盘退变的作用。
关键词:腰椎间盘退变;电针;夹脊穴;肌动蛋白;微管结合蛋白
Effects of Electroacupuncture at Jiaji(EX-B2) on the expression of actin and tubulin in rabbit degenerated intervertebral disc
Li Yanling1, Zou Jing2, Huang Guofu3
(1 Hubei University of Traditional Chinese Medicine,Wuhan 430065,China ;2 Wuhan Hospital of Integrated Chinese and Western Medicine,Wuhan 430022,China;3 WuChang Hospital Affiliated to Wuhan technology and science University,Wuhan 430063,China)
Abstract: Objective: To observe the effect of electroacupuncture at jiaji(EX-B2) on the expression of actin and tubulin in rabbit degenerated intervertebral disc so as to explore its mechanism in relieving intervertebral disc degeneration. Methods: A total of 40 New Zealand rabbits were randomly divided into normal, model, sham operation and EA groups, with 10 rabbits in each group. In model group, the lumbar intervertebral disc degeneration was established by using an axial compression device. EA group was treated with EA at bilateral jiaji(EX-B2) for 20 minutes, once daily for 28 days. The expression levels of actin and tubulin of the lumbar intervertebral disc(L4-L5) were assayed by Western blot at the 28th and 56th day after operation. Results: The expression levels of actin and tubulin on the postoperative day 28 in the model group and EA group were significantly declined as compared with the normal group and sham operation group (P<0.05). The expression levels of actin and tubulin on the postoperative day 56 in the EA group was significantly increased than that on the postoperative day 28 and in the model group on the postoperative day 56 (P<0.05). Conclusions: Electroacupuncture at jiaji(EX-B2) could increase the expression levels of actin and tubulin in rabbit degenerated intervertebral disc and delay the intervertebral disc degeneration through promoting the restoration of the cytoskeleton in degenerated intervertebral disc.
Key words: intervertebral disc degeneration;electroacupuncture;jiaji(EX-B2);actin;tubulin
椎间盘退变(intervertebral disc degeneration,IVDD)是一个多因素导致的病理过程,是椎间盘突出、椎管狭窄、脊柱失稳等脊柱退行性疾病的共同病理基础。有研究表明,非生理的生物力学环境及其导致的细胞外基质代谢变化是椎间盘退变的始动因素[1],而细胞骨架(cytoskeleton)可能作为机械信号传导通路的重要组成部分参与了胞外基质代谢的调节[2]。目前针灸在临床治疗腰椎间盘退行性疾病中备受青睐,前期研究已证明,电针对腰椎间盘退行性疾病有较好的疗效[3],但其具体机制尚未完全明确。因此,本实验从肌动蛋白(actin)、微管蛋白(tubulin)的角度研究电针对退变椎间盘细胞中细胞骨架蛋白的影响,探讨电针防治腰椎间盘退变性疾病的作用机制。
1 材料与方法
1.1 实验动物: 骨骼发育成熟的健康成年雄性新西兰大白兔40只,月龄5~6m,体重3.0~4.0kg,由武汉大学实验动物中心提供(动物质量合格证编号:42000500005471),适应性饲养3周后开始实验。
1.2 主要仪器和试剂: 轴向加压造模器(十堰东汽);电钻(型号JIZ-SH09-10C 6910JER,上海锐奇);Signa HDx 3.0T 磁共振器(美国通用);多功能实验兔固定器(北京创博环球);针灸针(φ0.30×25mm,华佗牌);HANS穴位神经刺激仪(南京济生);TS-1水平摇床(江苏海门其林贝尔);DYCZ-40电转仪、DYCZ-24DN垂直电泳槽、DYY-7C电泳仪电源(北京六一);丙烯酰胺(Amresco);PMSF、RIPA裂解液、BCA蛋白浓度测定试剂(碧云天);PVDF膜(Millipore);GAPDH抗体(abcam);一抗(NBP1-41294、NB600-506,novus);HRP标记羊抗兔二抗、HRP标记羊抗小鼠二抗(novus);ECL底物液(Thermo)。
1.3 实验方法 ①分组与造模:采用随机数字表法将40只新西兰大白兔分为正常组、模型组、假模型组、电针组4组,每组各10只。模型组与电针组参考Kroeber M等[4]及黄国付等[5]造模方法建立兔腰椎间盘退变模型。10%水合氯醛(1ml/kg)耳缘静脉注射麻醉后将新西兰大白兔俯卧位固定;备皮后于L4、L5椎体的椎旁两侧约2cm处做长约1cm的垂直切口,钝性分离各层组织,显露椎体;直径1.5mm的克氏针沿切口处钻入至针尖轻抵骨面,探寻相应椎体近尾端厚实处作为穿刺点,用电钻将克氏针水平钻入椎体内并从对侧皮肤穿出,过程中保持针身与脊柱垂直;缝合切口处皮肤,在每根克氏针两端等距处安装轴向加压造模器(图1),施加200N的压力持续28d(图2);最后肌肉注射青霉素钠4×106U,1次/d,连续治疗5d。术后28天拆除加压装置、拔除克氏针,4组实验兔每组各取5只进行MRI检查以评价造模是否成功。②动物干预:正常组:自然饲养,不作其他处理和治疗;模型组、假模型组:不作任何治疗;假模型组造模方式同模型组,但不安装轴向加压造模器,不进行椎体间加压;电针组:造模成功后第1天开始电针治疗。参照《实验针灸学》[6]取L4、L5双侧夹脊穴,1寸针灸针(φ0.30×25mm,华佗牌)直刺5~8mm后接以韩氏穴位神经刺激仪(同侧夹脊穴接通同一对电极),调频波2/15Hz,刺激强度1~2mA,持续时间为20min/次(图3),1次/d,连续治疗6d为1疗程,疗程间隔1d,共治疗4个疗程。

1.4 观察指标及检测方法: 每组分别在达到造模周期后第1天和第28天各取5只,拆除加压装置并拔除克氏针,用10%水合氯醛(1ml/kg)耳缘静脉注射麻醉后行L4-5椎间盘MRI平扫,之后处死并取出所需节段椎间盘组织,置于-70℃冰箱中保存供Western blot检测。
Western Blot检测MAPs和Actin的表达:按照实验试剂说明书,将所取椎间盘组织洗涤、裂解、离心后收集蛋白样品匀浆,BCA试剂测定蛋白样品的蛋白浓度;按照蛋白分子量配置10%PAGE凝胶,待目的蛋白充分分离即停止电泳,裁取目的凝胶后转膜;将PVDF膜置于含5%脱脂奶粉的TBST中室温下摇床封闭2h;再将PVDF膜浸于封闭液稀释(1:1000)的一抗溶液中,4℃摇床孵化过夜,TBST充分洗涤5~6次;二抗经封闭液稀释(1:10000)后浸泡PVDF膜,室温下摇床孵化2h后充分洗涤;再将ECL显影液均匀滴在PVDF膜蛋白面,暗室X光片显影;应用Band-Scan凝胶图像处理系统分析tubulin和actin平均吸光度。
1.5 统计学方法: 采用SPSS 17.0软件进行统计学分析,实验数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 磁共振影像检测椎间盘信号变化
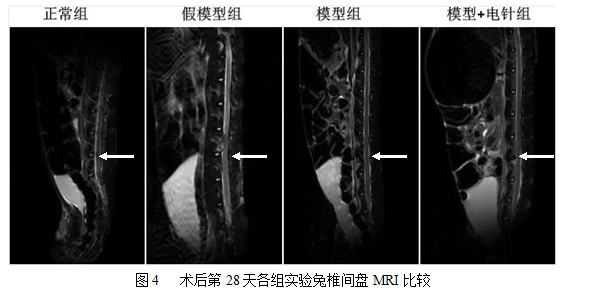
术后第28天各组实验兔拆除加压装置并拔除克氏针,使用Signa HDx 3.0T 磁共振器摄L4-5椎间盘T2加权(矢状位)像。结果显示:正常组与假模型组实验兔椎间盘各节段表现为均匀明亮的高信号,各椎间盘信号强度无明显差异;模型组与电针组L4-5椎间盘信号强度明显低于上下相邻椎间盘,表现为黑色低信号,与正常椎间盘差异明显,表明成功建立椎间盘退变模型。见图4。
2.2 椎间盘细胞中actin相对表达量组间比较
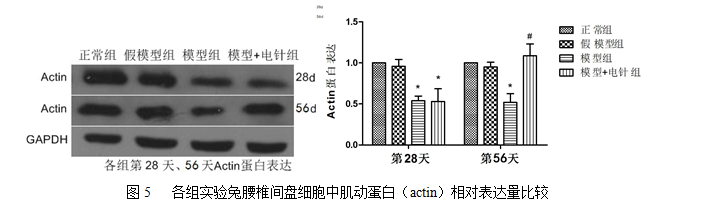
正常组与假模型组术后不同时间点actin表达差异均无统计学意义(P>0.05);模型组术后第28天actin表达与该组术后第56天相比差异无统计学意义(P>0.05);模型组及电针组术后第28天actin表达与正常组及假模型组术后第28天相比均有明显下降(P<0.05);电针组经电针治疗28天actin表达与该组术后第28天及模型组术后第56天相比均有明显升高(P<0.05)。见图5,表1。
2.3 椎间盘细胞中tubulin相对表达量组间比较
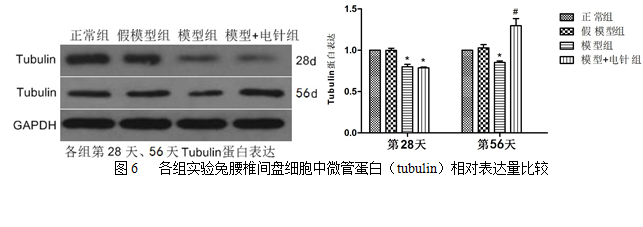

正常组与假模型组术后不同时间点tubulin表达差异均无统计学意义(P>0.05);模型组术后第28天tubulin表达与该组术后第56天相比差异无统计学意义(P>0.05);模型组及电针组术后第28天tubulin表达与正常组及假模型组术后第28天相比均有明显下降(P<0.05);电针组经电针治疗28天tubulin表达与该组术后第28天及模型组术后第56天相比均有明显升高(P<0.05)。见图6、表2。
3 讨论
椎间盘的解剖结构是由纤维环、髓核和软骨终板组成。在正常情况下,椎间盘可分散和缓冲脊柱压力负荷,但髓核和纤维环细胞所承载的应力不完全相同。研究发现,非生理条件下的机械负荷可能影响髓核和纤维环细胞的合成和分解代谢,进而引起胞外基质的成分变化。椎间盘细胞外基质具有复杂的生物力学性能,其构成的变化可进一步影响椎间盘的力学分布,最终影响椎间盘的形态和结构。因此,非正常机械应力是引起椎间盘退变的最重要原因之一。然而,椎间盘细胞将外界机械力信号转化为生物化学信号从而引起胞外基质成分改变的机制仍不十分清楚。有研究提出,细胞骨架可能在这一信号传导过程中起到重要作用[7]。
细胞骨架蛋白是指细胞质中由蛋白丝组成的非膜相结构系统的蛋白质,椎间盘细胞中的细胞骨架蛋白有肌动蛋白、微管蛋白和波形蛋白(vimentin)等。力学信号在细胞内部深层的传导主要通过细胞骨架蛋白实现,机械力刺激作用于椎间盘细胞时,细胞外基质结合细胞骨架,介导细胞内蛋白构象的改变。肌动蛋白是细胞运动、维持形态、跨膜转运及信号转导等的基础。张德宏等[1]发现,大鼠纤维环细胞肌动蛋白骨架在静态培养时呈现明显的应力纤维,而不同幅度和时间的牵拉可影响肌动蛋白骨架的聚合和解聚,提示细胞骨架组成的结构变异对椎间盘细胞的力学功能起到重要作用。于胜吉等[8]发现,椎间盘细胞受到直接外力作用后,肌动蛋白收缩且表达相应降低,细胞体积缩小,形态发生改变。研究表明,椎间盘细胞受到机械应力时可通过激活Ca2+通道导致细胞内Ca2+瞬间变化,从而引起肌动蛋白的重塑,有利于渗透性应力下细胞体积的重塑[9]。微管蛋白主要参与细胞内物质转运、维持细胞形态及细胞器定位等功能活动。椎间盘细胞中微管蛋白的表达和分布随年龄的增长出现明显变化,导致其对机械应力的反应发生改变,进而影响胞外基质的代谢。Li S等[2,10]研究证实,体外培养的椎间盘细胞在牵张力作用下出现结构和表达的明显改变,当软骨细胞中微管蛋白的表达受到干扰时可抑制压力诱导的蛋白聚糖的合成和分泌。综上所述,生理状况下,细胞骨架蛋白将作用于椎间盘细胞的机械力刺激转化生物化学信号,维持胞外基质的正常代谢平衡;而异常的机械应力可引起细胞骨架蛋白结构及表达发生改变,力学信号转导通路异常,进而影响椎间盘细胞外基质的合成和分解代谢,导致椎间盘的退变。
本实验参考Kroeber M等[4]通过压力装置诱发椎间盘退变的造模方法,在相邻两椎体间进行轴向加压,通过过度的机械刺激作用于椎间盘细胞引起细胞骨架蛋白的表达变化,从而建立椎间盘退变模型。实验结果显示,模型组术后第28天、第56天及电针组术后第28天actin、tubulin表达较正常组及假模型组术后第28天、第56天相比均明显下降,说明轴向加压可诱导椎间盘退变的发生,退变的椎间盘细胞中actin、tubulin表达下调;而电针组经电针治疗28天后actin、tubulin表达明显升高,说明电针可有效上调退变椎间盘细胞中actin、tubulin的表达。前期研究表明,电针夹脊穴可通过降低椎间盘组织中基质金属蛋白酶13(MMP-13)、增强基质金属蛋白酶组织抑制因子1(TIMP-1),纠正基质降解和合成代谢之间的失衡,从而延缓椎间盘退变[11]。因此,我们认为电针可通过上调退变椎间盘细胞中actin、tubulin的表达,促进退变椎间盘细胞骨架恢复,从而调节椎间盘细胞外基质的合成和分解代谢,达到延缓椎间盘退变的作用。有研究认为,胞外刺激如应力刺激等,可通过磷酸化tubulin、actin等增加AQPs(水通道蛋白)mRNA的转录和蛋白合成,从而改变微管、微丝等细胞骨架对AQPs的转运[12-14]。课题组前期研究已证实[15],退变椎间盘组织中AQP1、3表达降低,而电针可有效上调模型兔退变椎间盘组织中AQP1、3的表达。基于此我们推测,电针可通过上调退变椎间盘细胞中actin、tubulin的表达,进而上调终板软骨细胞AQP1、3表达,从而延缓椎间盘退变。本研究为阐明电针治疗腰椎间盘退行性疾病的可能机制提供了一定的实验依据,为临床应用电针治疗腰椎间盘退行性疾病提供了理论依据,但细胞骨架蛋白与AQPs之间的关系仍待进一步研究。
参考文献
[1] 张德宏, 方鹏飞, 王兴盛,等. 周期性牵张椎间盘纤维环细胞肌动蛋白骨架的重排. 中国组织工程研究[J], 2016, 20(7): 972-980.
[2] 薛荣亮, 李思远. 细胞骨架与机械信号传导:椎间盘突出机制研究的新靶点. 中国疼痛医学杂志[J], 2016, 22(5): 326-328.
[3] 黄国付, 张红星, 张唐法. 夹脊平衡电针治疗腰椎间盘突出症的临床研究. 中国康复医学杂志[J], 2008, 23(3): 236-237.
[4] Kroeber M, Unglaub F, Guegring T, et al. Effects of controlled dynamic disc distraction on degenerated intervertebral discs: an in vivo study on the rabbit lumbar spine model. Spine, 2005, 30(2): 181-187.
[5] 黄国付, 汪伯毅, 邹璟,等. 夹脊电针对兔退变腰椎间盘组织中decorin蛋白表达的影响. 中国康复[J], 2015, 30(5): 323-327.
[6] 郭义. 实验针灸学[M]. 北京: 中国中医药出版社, 2008: 402-417.
[7] Li S, Duance VC, Blain EJ. Zonal variations in cytoskeletal element organization, mRNA and protein expression in the intervertebral disc. J Anat, 2008, 213(6): 725-732.
[8] 于胜吉,邱贵兴,Yang BL.周期性压力下椎间盘细胞中肌动蛋白的变化及其意义.中华骨科杂志[J],2005,25(9):560-564.
[9] Irving M. Shapiro,Makarand V. Risbud. 椎间盘[M].北京: 北京大学医学出版社 ,2016: 106-107.
[10] Li S, Jia X, Duance VC, et al .The effects of cyclic tensile strain on the organisation and expression of cytoskeletal elements in bovine intervertebral disc cells: an in vitro study. Eur Cell Mater, 2011, 21: 508-522.
[11] 邹璟,黄国付,张琦,等.“夹脊”电针对兔退变腰椎间盘组织中基质金属蛋白酶13和基质金属蛋白酶组织抑制因子1表达的影响.针刺研究[J],2014,39(3):192-197.
[12] S.Sindhu Kumari, Murali Varadaraj, Venkata S. Yerramilli, et al. Spatial expression of aquaporin 5 in mammalian cornea and lens, and regulation of its localization by phosphokinase A. Molecular Vision, 2012, 18: 957-967.
[13] GonzalezGA, MontminyMR. Cyclic AMP stimulates somatostatin gene transcription by phosphorylation of CREB at serine133. Cell, 1989, 59: 675-680.
[14] Venkataramana K. Sidhaye, Eric Chau, Vasudha Srivastava, et al. A Novel Role for Aquaporin-5 in Enhancing Microtubule Organization and Stability. PLoS ONE, 2012, 7(6): 1-9.
[15] 李解. LDH临床症状与MRI相关性研究及电针对模型兔退变腰椎间盘软骨终板AQP1、3表达的影响[D].武汉: 湖北省中医药大学, 2016.

 世界针灸学会联合会
世界针灸学会联合会